题目内容
【题目】设阿伏加德罗常数的值为N![]() ,关于反应
,关于反应 下列说法错误的是
下列说法错误的是
A.8.8gCO2中共用电子对的数目为0.8NA
B.消耗CO24.48L(标准状况下)时转移电子的数目为0.8NA
C.12g金刚石(C)中所含共价键的数目为4NA
D.0.1molMgO中所有离子的最外层电子数之和为1.6NA
【答案】C
【解析】
A. 一个 ![]() 分子中共用电子对的数目为
分子中共用电子对的数目为 ![]() 对,
对,![]() 为
为 ![]() ,即
,即 ![]() ,故A正确;
,故A正确;
B. 根据给出的反应式可知当 ![]() 参与反应时,转移电子数目为
参与反应时,转移电子数目为 ![]() ,则消耗
,则消耗 ![]() 即
即 ![]() 时,转移电子数为
时,转移电子数为 ![]() ,故B正确;
,故B正确;
C. ![]() 金刚石为
金刚石为 ![]() ,其中
,其中 ![]() 键的数目为
键的数目为 ![]() ,故C错误;
,故C错误;
D. ![]() 中各原子均达到
中各原子均达到 ![]() 电子稳定结构,故最外层电子数之和为 16。当
电子稳定结构,故最外层电子数之和为 16。当 ![]() 时,最外层电子数之和为
时,最外层电子数之和为 ![]() ,故D正确;
,故D正确;
故答案选C。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
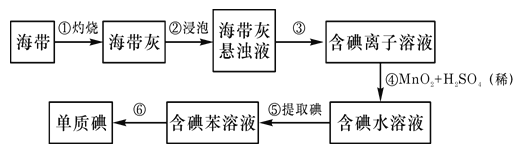
名校名卷单元同步训练测试题系列答案【题目】某化学实验小组用酸性KMnO4溶液和草酸(H2C2O4)溶液反应,研究外界条件反应速率的影响,实验操作及现象如下:
编号 | 实验操作 | 实验现象 |
I | 向一支试管中先加入1mL 0.01 mol/L酸性 KMnO4溶液,再加入1滴3mol/L硫酸和9滴蒸馏水,最后加入1mL 0.1mol/L草酸溶液 | 前10min内溶液紫色无明显变化,后颜色逐渐变浅, 30 in后几乎变为无色 |
II | 向另一支试管中先加入1mL 0.01mol/L酸性 KMnO4溶液,再加入10滴3mol/L硫酸,最后加入1mL 0.1mol/L草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
(1)高锰酸钾与草酸反应的离子方程式:______________________________________
(2)由实验I、II可得出的结论是____________________________。
(3)关于实验II中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的Mn2+对反应有催化作用。利用提供的试剂设计实验III,验证猜想。
提供的试剂:0.01mol/L酸性 KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
① 补全实验III的操作:向试管中先加入1mL 0.01mol/L酸性 KMnO4溶液,______,最后加入1mL 0.1mol/L草酸溶液。
② 若猜想成立,应观察到的实验现象是______。
(4)该小组拟采用如图所示的实验方案继续探究外界条件对反应速率的影响。
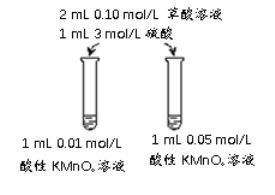
① 他们拟研究的影响因素是______。
② 你认为他们的实验方案______(填“合理”或“不合理”),理由是______。