题目内容
【题目】镁在空气中燃烧除生成MgO外,还可能生成Mg3N2。某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成。
(1)甲组同学取一定量燃烧后的固体投入水中,得到了一种能使湿润的红色石蕊试纸变蓝 的气体,该气体的化学式为__________,说明固体中含有Mg3N2,生成该气体的化学反应方程式为_________________________。
(2)乙组同学为测定Mg3N2含量,用图示装置进行实验,充分反应后再加热A。其中浓硫酸的作用是_____,对A加热的目的是______________________________________。已知加入的固体质量为4.0g,最终C装置增重ag,则固体中含Mg3N2 _______g(用含a的式子表示)。
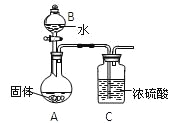
(3)丙组有的同学认为乙组同学的测定结果偏高,理由是__________________________________________________________________________________________________。
有的同学认为乙组同学的测定结果偏低,理由是____________________________________________________________________________________________________________。
丙组同学进行了改进,他们将乙组同学实验中得到的难溶固体进行过滤、洗涤、干燥,并
灼烧固体至恒重,测得其质量为4.08g。上述过程中,洗涤沉淀的操作是_______________________________________________________________________________________。
镁在空气中燃烧后生成的固体中Mg3N2的质量分数为_____________。
(4)有一种用铵盐与含镁矿石混合煅烧制取氧化镁的方法,解决了现有方法存在的原料成 本高、项目投资大、能耗高、副产品不好用等问题,其原理是将含镁矿石粉(含氧化镁)与 铵盐混合,经过煅烧、水溶、过滤,得到粗镁盐溶液,并回收煅烧产生的氨。写出用固体(NH4)2SO4与含镁矿石粉煅烧的化学反应方程式__________________________________________________________________________________________。
【答案】NH3 Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3↑ 吸收生成的NH3 将装置A中反应产生的NH3全部驱赶到装置C中 ![]() C装置的两侧无干燥装置,NH3中的水蒸气以及外部空气中的水蒸气都可能进入C装置而被浓硫酸吸收,造成结果偏高 可能有部分NH3滞留在装置内没有完全被浓硫酸吸收,从而造成结果偏低 向过滤器中的沉淀上加蒸馏水至完全浸没沉淀,待水全部流出后,重复操作2~3次 10% (NH4)2SO4+MgO
C装置的两侧无干燥装置,NH3中的水蒸气以及外部空气中的水蒸气都可能进入C装置而被浓硫酸吸收,造成结果偏高 可能有部分NH3滞留在装置内没有完全被浓硫酸吸收,从而造成结果偏低 向过滤器中的沉淀上加蒸馏水至完全浸没沉淀,待水全部流出后,重复操作2~3次 10% (NH4)2SO4+MgO![]() MgSO4+2NH3↑+H2O
MgSO4+2NH3↑+H2O
【解析】
(1)能使湿润的红色石蕊试纸变蓝的气体是NH3,Mg3N2与水反应生成Mg(OH)2和NH3。
(2)浓硫酸是酸性干燥剂,可吸收NH3,对A加热可促使NH3挥发,使反应产生的NH3全部被C装置吸收,则由关系式Mg3N2~2NH3可求出a g NH3对应![]() g Mg3N2。
g Mg3N2。
(3)A装置中产生的NH3会含有水蒸气,C装置中浓H2SO4既吸收NH3,也吸收NH3中的水蒸气,而且C装置后未连接隔绝空气中水蒸气的装置,所以C装置增重的a g中包括水蒸气的质量,造成测定结果偏高。反应产生的NH3在反应结束后由于气压的原因无法全部被排出,而在装置中滞留一部分,造成产生的NH3不能全部被浓硫酸吸收,所以会造成测定结果偏低。
丙组同学所得4.08 g固体是MgO,包括原混合物中的MgO和Mg3N2转化来的MgO(Mg3N2~3Mg(OH)2~3MgO),
Mg3N2→ 3MgO △m(固体增重)
100g 120g 20g
m(Mg3N2) 0.08g
100g:20g= m(Mg3N2):0.08g,解得m(Mg3N2)=0.4g
故镁在空气中燃烧后生成的固体中Mg3N2的质量分数为![]() ×100% =10%。
×100% =10%。
(4)含镁矿石粉中含MgO,MgO与(NH4)2SO4高温反应生成MgSO4、NH3和H2O。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案