题目内容
【题目】海带中含有丰富的碘。为从海带中提取碘,某研究性学习小组设计并进行以下实验:
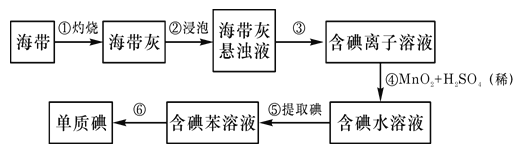
请填写下列空白:
(1)步骤③中过滤操作时,除需要铁架台、烧杯等,还需用到的玻璃仪器是___。
(2)步骤④中反应的离子方程式是___。
(3)步骤⑤和⑥的实验操作名称分别是___和____。
(4)步骤⑤中,某学生选择用CCl4来提取碘的理由是:CCl4与碘单质不反应,___。
(5)酸性条件下,若用IO3-将I-氧化为I2,则I-和IO3-的物质的量之比为___。
(6)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法___。
【答案】普通漏斗、玻璃棒 2I-+MnO2+4H+=Mn2++I2+2H2O 萃取 蒸馏 CCl4与水互不相溶并且与水不反应,碘在CCl4中的溶解度比在水中大 5:1 取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,如果变蓝,说明还有单质碘;如果未变蓝,说明没有单质碘
【解析】
(1)步骤③中过滤操作时,需要使用铁架台、烧杯、漏斗、玻璃棒等仪器。
(2)步骤④中,MnO2将I-氧化为I2,自身被还原为Mn2+。
(3)步骤⑤是苯将I2从水溶液中转移到苯溶液中;步骤⑥是分离碘的苯溶液。
(4)步骤⑤中,某学生选择用CCl4来提取碘的理由是:不反应,不互溶,溶解度大。
(5)酸性条件下,若用IO3-将I-氧化为I2,则I-和IO3-的物质的量之比,可利用电子守恒进行分析。
(6检验提取碘后的水溶液中是否还含有单质碘,应使用淀粉溶液。
(1)步骤③中过滤操作时,需要使用铁架台、烧杯、漏斗、玻璃棒等仪器,从而得出缺少的仪器为普通漏斗、玻璃棒。答案为:普通漏斗、玻璃棒;
(2)步骤④中,MnO2将I-氧化为I2,自身被还原为Mn2+,反应的离子方程式为2I-+MnO2+4H+=Mn2++I2+2H2O。答案为:2I-+MnO2+4H+=Mn2++I2+2H2O;
(3)步骤⑤是苯将I2从水溶液中转移到苯溶液中,操作名称为萃取;步骤⑥是分离碘的苯溶液,操作名称为蒸馏。答案为:萃取;蒸馏;
(4)步骤⑤中,某学生选择用CCl4来提取碘的理由是:CCl4与水互不相溶并且与水不反应,碘在CCl4中的溶解度比在水中大。答案为:CCl4与水互不相溶并且与水不反应,碘在CCl4中的溶解度比在水中大;
(5)酸性条件下,若用IO3-将I-氧化为I2,IO3-转化为I2,化合价降低5价,I-转化为I2,化合价升高1价,依据电子守恒,则I-和IO3-的物质的量之比为5:1。答案为:5:1;
(6)检验提取碘后的水溶液中是否还含有单质碘的简单方法为取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,如果变蓝,说明还有单质碘;如果未变蓝,说明没有单质碘。答案为:取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,如果变蓝,说明还有单质碘;如果未变蓝,说明没有单质碘。

 名校课堂系列答案
名校课堂系列答案