题目内容
2.下列实验事实,不能证明苯分子中的碳碳键不是单、双键交替,而是一种介于碳碳单键与碳碳双键之间的特殊的共价键的是( )| A. | 苯不能使酸性高锰酸钾溶液褪色 | B. | 苯的邻二氯取代产物只有一种 | ||
| C. | 苯不使溴的四氯化碳溶液褪色 | D. | 苯的对二氯取代产物只有一种 |
分析 A.如果苯是单双键交替结构,则含碳碳双键,根据双键的性质来分析;
B.根据苯的结构中存在单双键交替结构,苯的邻二氯取代物有两种,但实际上无同分异构体来分析;
C.如果苯是单双键交替结构,则含碳碳双键,根据双键的性质来分析;
D.根据苯的结构中是否有碳碳双键和碳碳单键,苯的对二氯取代物都无同分异构体来分析.
解答 解:A.如果苯是单双键交替结构,则含碳碳双键,而碳碳双键能被酸性高锰酸钾氧化从而使酸性高锰酸钾溶液褪色,但现在事实是苯不能使酸性高锰酸钾溶液褪色,说明苯中不含碳碳双键,即苯不是单双键交替结构,故A不选;
B.若苯的结构中存在单双键交替结构,苯的邻位二元取代物有两种,但实际上只有以中国结构,所以能说明苯不是单双键交替结构,故B不选;
C.如果苯是单双键交替结构,则含碳碳双键,则能和溴发生加成反应而使溴的四氯化碳溶液褪色,而事实是苯不使溴的四氯化碳溶液褪色,即苯中不含碳碳双键,说明苯不是单双键交替的结构,故C不选;
D.无论苯的结构中是否有碳碳双键和碳碳单键,苯的对位二元取代物都无同分异构体,所以不能说明苯不是单双键交替结构,故D选.
故选D.
点评 本题考查了苯的结构,应注意的是苯不是单双键交替的结构,苯中的键是介于单双键之间的特殊的键,难度不大.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
13.下列反应中,起固氮作用的是( )
| A. | NH3经催化氧化生成NO | B. | NO与O2反应生成NO2 | ||
| C. | N2与H2在一定条件下反应生成NH3 | D. | 由NH3制碳酸氢铵和硫酸铵 |
10.实验室中以下物质的贮存方法,不正确的是( )
| A. | 保存硫酸亚铁溶液时,向其中加入铁钉和少量硫酸 | |
| B. | 少量金属钠保存在煤油中 | |
| C. | 少量液溴可用水封存,防止溴挥发 | |
| D. | 浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处 |
17.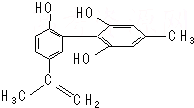 我国支持“人文奥运”,坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”,坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
 我国支持“人文奥运”,坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”,坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 | |
| C. | 该分子中的所有原子有可能共平面 | |
| D. | 1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol |
7.以下物质:(1)甲烷;(2)苯;(3)聚乙烯;(4)乙醇;(5)乙炔;(6)环己烷; (7)乙酸;(8)苯乙烯(C6H5-CH=CH2).既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是( )
| A. | (3)(5)(8) | B. | (5)(7)(8) | C. | (5)(8) | D. | (3)(5)(7)(8) |
14.NOx是大气污染的主要污染物之一.
(1)硝酸厂常用如下三种方法处理氮氧化物(NO与NO2)尾气
①催化还原法:在催化剂存在时用H2将NO2还原为N2,
②Na2CO3溶液吸收法:用Na2CO3溶液吸收NO2生成CO2,若9.2g NO2和Na2CO3溶液完全反应时转移0.1mol电子,则反应的离子方程式为2NO2+CO32-=NO3-+NO2-+CO2.
③烧碱吸收法:氮氧化物(NO与NO2)用烧碱进行吸收,产物为NaNO2、NaNO3和H2O,现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收.已知反应后溶液中含有0.35mo1NaNO2,若将尾气中NO与NO2的平均组成记为NOx,则x=1.8.
(2)现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体在标准状况下的体积与剩余固体的质量如表:
①稀硝酸的浓度为4mol•L-1
②计算原混合物中铁和铜的物质的量比为2:1;
③加入400mL稀硝酸,反应完全后,溶液中硝酸根离子的物质的量为1.2mol.
(1)硝酸厂常用如下三种方法处理氮氧化物(NO与NO2)尾气
①催化还原法:在催化剂存在时用H2将NO2还原为N2,
②Na2CO3溶液吸收法:用Na2CO3溶液吸收NO2生成CO2,若9.2g NO2和Na2CO3溶液完全反应时转移0.1mol电子,则反应的离子方程式为2NO2+CO32-=NO3-+NO2-+CO2.
③烧碱吸收法:氮氧化物(NO与NO2)用烧碱进行吸收,产物为NaNO2、NaNO3和H2O,现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收.已知反应后溶液中含有0.35mo1NaNO2,若将尾气中NO与NO2的平均组成记为NOx,则x=1.8.
(2)现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体在标准状况下的体积与剩余固体的质量如表:
| 硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
| 放出气体的体积(mL) | 2240 | 4480 | 6720 | 8960mL |
②计算原混合物中铁和铜的物质的量比为2:1;
③加入400mL稀硝酸,反应完全后,溶液中硝酸根离子的物质的量为1.2mol.
11.将18g铜和铁的混合物投入200mL稀硝酸中,充分反应后得到标准状况下2.24L NO,剩余9.6g金属;继续加入200mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24L NO.若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法中正确的是( )
| A. | 原混合物中铜和铁各0.15 mol | |
| B. | 稀硝酸的物质的量浓度为1 mol•L-1 | |
| C. | 第一次剩余9.6 g金属为铜和铁 | |
| D. | 再加入上述200 mL稀硝酸,还会得到标准状况下2.24 L NO |
12.下列有关化学用语表达不正确的是( )
| A. | CO2分子的结构式:O=C=O | B. | 氮气的电子式: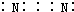 | ||
| C. | 钙离子的电子式:Ca2+ | D. | Na的原子结构示意图: |
