题目内容
17.下列关于元素周期表中“短周期”的叙述中不正确的是( )| A. | 共包含18种元素 | B. | 前3周期元素 | ||
| C. | 除稀有气体外,Cl的原子半径最大 | D. | 仅含5种金属元素 |
分析 A、短周期元素共18种;
B、一、二、三周期为短周期;
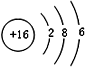
C、序数越大,核内质子越大,对电子的引力越大,使得原子半径反而小,所以同一周期,除了稀有气体元素,序数小的原子半径最大;
D、锂、铍、钠、镁、铝五种元素.
解答 解:A、短周期元素共18种,故A正确;
B、一、二、三周期为短周期,前3周期是短周期,故B正确;
C、序数越大,核内质子越大,对电子的引力越大,使得原子半径反而小,所以同一周期,除了稀有气体元素,序数小的原子半径最大,所以钠的原子半径大,故C错误;
D、锂、铍、钠、镁、铝五种元素,故D正确;
故选C.
点评 本题考查元素周期表的结构,学生只要熟记短周期元素的种类,就可以迅速解题,比较容易.

练习册系列答案
相关题目
7.观察电子处于1s轨道的电子云图,判断下列说法正确的是( )


| A. | 一个小黑点表示1个自由运动的电子 | |
| B. | 1s轨道的电子云形状为圆形的面 | |
| C. | 电子在1s轨道上运动像地球围绕太阳旋转 | |
| D. | 1s轨道电子云图中小黑点的疏密表示电子在某一位置出现机会的多少 |
8.与NH${\;}_{4}^{+}$具有相同电子总数和质子总数的是( )
| A. | Ne | B. | F- | C. | Na+ | D. | K+ |
12.下列实验操作、现象和结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将饱和FeCl3溶液滴入沸水中 | 溶液变红褐色 | 有Fe(OH)3生成 |
| B | 向Na2S溶液中滴加盐酸 | 产生气泡 | Cl的非金属性比S强 |
| C | 向溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中含有SO42- |
| D | 用导线连接铜片和锌片后插进盐酸中 | 铜片上有气泡 | 铜片是原电池的正极 |
| A. | A | B. | B | C. | C | D. | D |
2.下列化学名词或名称正确的是( )
| A. | 石炭酸 | B. | 三溴笨酚 | C. | 脂基 | D. | 2-甲基丁烷 |
6.下列物质能发生消去反应的是( )
| A. | CH3Br | B. | 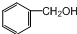 | C. | 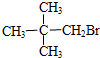 | D. | 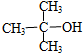 |
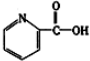 ②阿斯匹林
②阿斯匹林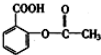
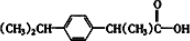 ④东茛菪内酯
④东茛菪内酯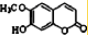
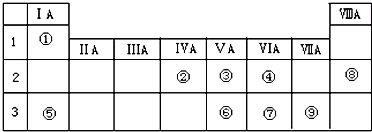
 ;
; .
.