题目内容
13.某小组要探究卤族元素的非金属性强弱,设计了如下实验,请按要求填空.| 实验 | 现象 | 离子方程式 |
| 1.将少量氯水分别加入盛有NaBr溶液(试管①)和KI溶液(试管②)中,用力振荡后加入少量四氯化碳,振荡,静置 | 写出试管②中的实验现象 溶液分层下层为紫红色 | 写出试管①中的离子方程式: Cl2+2Br-=2Cl-+Br2 |
| 2.将少量溴水加入盛有KI溶液(试管③)中,用力振荡后加入少量四氯化碳,振荡,静置 | 现象略 | 写出试管③中的离子方程式: Br2+2I-=2Br-+I2 |
| 实验结论: 元素非金属性由强到弱的顺序为:Cl>Br>I. | ||
分析 元素的非金属性越强,其单质的氧化性越强,同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;氯气能氧化溴离子生成溴单质,能氧化碘离子生成碘单质,溴能氧化碘离子生成碘单质,据此判断非金属性强弱.
解答 解:将少量氯水滴入KI溶液中,用力振荡后加入少量四氯化碳,振荡,静置,发现KI溶液分层,且下层溶液呈紫色,说明氯气将碘离子氧化生成碘单质;
将少量氯水滴入NaBr溶液中,用力振荡后加入少量四氯化碳,振荡,静置,发现NaBr溶液分层,且下层溶液呈橙色,说明氯气将溴离子氧化生成溴单质,离子反应方程式为Cl2+2Br-=2 Cl-+Br2;
将少量溴水加入盛有KI溶液(试管③)中,用力振荡后加入少量四氯化碳,振荡,静置,溶液分层且下层为紫红色,说明溴将碘离子氧化生成碘单质,离子方程式为Br2+2I-=2 Br-+I2,
①中氧化剂是Cl2、氧化产物是Br2,②中氧化剂是Cl2、氧化产物的I2,③中氧化剂是Br2、氧化产物是I2,
所以氧化性强弱顺序是Cl2>Br2>I2,元素的非金属性越强,其单质的氧化性越强,所以非金属性强弱顺序是Cl>Br>I,
故答案为:
| 实验 | 现象 | 离子方程式 |
| 溶液分层下层为紫红色 | Cl2+2Br-=2 Cl-+Br2 | |
| Br2+2I-=2 Br-+I2 | ||
| Cl>Br>I | ||
点评 本题以卤素单质之间的置换反应为载体考查同一主族元素性质递变规律,明确非金属性强弱与其单质氧化性强弱关系是解本题关键,易错点是化学用语正确运用,题目难度不大.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
1.下列属于吸热化学反应的是( )
| A. | 液态水气化 | B. | 醋酸的电离 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl(s)混合 |
8.与NH${\;}_{4}^{+}$具有相同电子总数和质子总数的是( )
| A. | Ne | B. | F- | C. | Na+ | D. | K+ |
2.下列化学名词或名称正确的是( )
| A. | 石炭酸 | B. | 三溴笨酚 | C. | 脂基 | D. | 2-甲基丁烷 |
3.下列说法正确的是( )
| A. | 核外电子排布相同的微粒,其化学性质也相同 | |
| B. | 含有金属元素和非金属元素的化合物不一定是离子化合物 | |
| C. | 仅含非金属元素的化合物一定是共价化合物 | |
| D. | 凡需要加热的反应一定是吸热反应 |
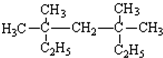 系统命名为:3,3,5,5-四甲基庚烷.
系统命名为:3,3,5,5-四甲基庚烷.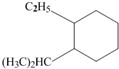 的炔烃的结构简式:
的炔烃的结构简式: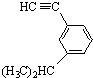 .
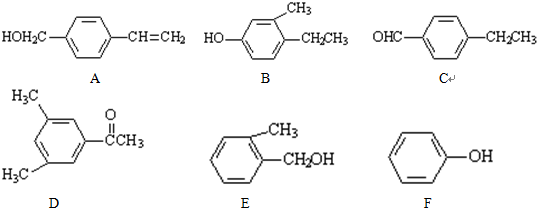
.
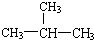
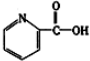 ②阿斯匹林
②阿斯匹林
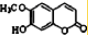
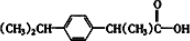 ④东茛菪内酯
④东茛菪内酯