题目内容
16.下列说法正确的是( )| A. | 强电解质溶液的导电能力一定比弱电解质溶液的强 | |
| B. | 氨气是弱电解质,铜是强电解质 | |
| C. | 氧化钠是强电解质,醋酸是弱电解质 | |
| D. | 硫酸钠是强电解质,硫酸钡是弱电解质 |
分析 A.溶液导电能力由溶液中离子浓度大小决定,与电解质强弱无关;
B.非电解质在水溶液和熔化状态下都不能导电的化合物,包括非金属氧化物,氨气为非电解质,铜不属于电解质;
C.强电解质是在熔融状态下或在水溶液能完全电离的电解质,弱电解质是在水溶液里或在熔融状态下部分电离的电解质;
D.硫酸钠和硫酸钡在熔融状态下或在水溶液里都完全电离,都属于强电解质.
解答 解:A.强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强,溶液的导电能力与离子浓度成正比,浓度大的弱电解质其导电性比浓度很小的强电解质溶液的导电性大,故A错误;
B.氨气的水溶液能导电,原因是氨气和水反应生成一水合氨,一水合氨能电离出自由移动的阴阳离子而使溶液导电,一水合氨是电解质,氨气是非电解质,铜是单质,电解质必须是化合物,铜属于单质不是电解质,故B错误;
C.氧化钠在熔融状态下能够完全电离,能导电,属于电解质,醋酸溶于水能够部分电离,属于弱电解质,故C正确;
D.硫酸钠在熔融状态下或在水溶液里都完全电离是强电解质,硫酸钡难溶于水,但溶于水的那部分是完全电离,在熔融状态下能够完全电离,所以强是电解质,故D错误;
故选C.
点评 本题考查了强弱电解质的判断、电解质和非电解质的判断等知识点,注意强电解质溶液的导电能力不一定强,导电能力强的溶液不一定是强电解质溶液,为易错点,题目难度不大.

练习册系列答案
相关题目
6.下列分子中所有原子都在同一条直线上的是( )
| A. | C2H2 | B. | C2H4 | C. | C2H6 | D. | CH4 |
7.观察电子处于1s轨道的电子云图,判断下列说法正确的是( )


| A. | 一个小黑点表示1个自由运动的电子 | |
| B. | 1s轨道的电子云形状为圆形的面 | |
| C. | 电子在1s轨道上运动像地球围绕太阳旋转 | |
| D. | 1s轨道电子云图中小黑点的疏密表示电子在某一位置出现机会的多少 |
11.下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题.
(1)金属性最强的元素是钙(填元素名称);
(2)a原子结构示意图为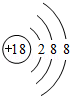 ;
;
(3)与a的电子层结构相同的3种简单离子的半径有小到大的顺序是Ca2+<Cl-<S2-(填离子符号);
(4)g是带来人类文明的重要元素之一,其氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(5)c、d的单质在加热条件下生成物质X,其中含有化学键的类型为离子键、共价键;该物质中阴离子与阳离子个数比1:2.
(6)写出一个由其中某种元素的最高价氧化物对应的水化物与其最低价氢化物反应生成的化合物的化学反应方程式:NH3+HNO3=NH4NO3.
| 主族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅤⅡA | O |
| 2 | b | h | c | |||||
| 3 | d | i | g | j | e | a | ||
| 4 | f |
(2)a原子结构示意图为
 ;
;(3)与a的电子层结构相同的3种简单离子的半径有小到大的顺序是Ca2+<Cl-<S2-(填离子符号);
(4)g是带来人类文明的重要元素之一,其氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(5)c、d的单质在加热条件下生成物质X,其中含有化学键的类型为离子键、共价键;该物质中阴离子与阳离子个数比1:2.
(6)写出一个由其中某种元素的最高价氧化物对应的水化物与其最低价氢化物反应生成的化合物的化学反应方程式:NH3+HNO3=NH4NO3.
1.下列属于吸热化学反应的是( )
| A. | 液态水气化 | B. | 醋酸的电离 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl(s)混合 |
8.与NH${\;}_{4}^{+}$具有相同电子总数和质子总数的是( )
| A. | Ne | B. | F- | C. | Na+ | D. | K+ |
6.下列物质能发生消去反应的是( )
| A. | CH3Br | B. | 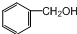 | C. | 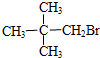 | D. | 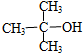 |
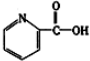 ②阿斯匹林
②阿斯匹林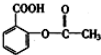
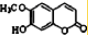
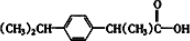 ④东茛菪内酯
④东茛菪内酯