题目内容
20.现有原子序数依次增大的A、B、C、D、E、F六种短周期元素.已知A、C、E三原子的最外电子层中共有10个电子,这三种元素的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水.请回答:(1)B元素在元素周期表中的位置是第三周期第ⅡA族,D可用于半导体材料,其元素符号是Si.
(2)E、F两元素的最高价氧化物的水化物中,酸性较强的是HClO4(填化学式).
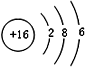
(3)写出A元素的原子结构示意图是
 ,A和E元素形成的化合物所含有的化学键是离子键.
,A和E元素形成的化合物所含有的化学键是离子键.(4)A、C、F的最高价氧化物对应水化物中,具有两性的是Al(OH)3(填化学式),A与C的最高价氧化物对应水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(5)A元素的原子与氧原子按1:1的个数比形成的化合物11.7g与足量二氧化碳完全反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2,有0.15mol 电子发生转移.
(6)由H、N、O三种元素组成的离子化合物X,在 210℃可分解生成N元素的一种气态氧化物Y和水.已知 40g X完全分解可生成11.2L(标准状况)Y,则Y的化学式为N2O.
分析 A、B、C、D、E、F为原子序数依次增大的短周期主族元素,A、C、E三种元素原子的最外层共有10个电子,三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,应是氢氧化铝与强碱、强酸的反应,则A为Na,C为Al,E原子最外层电子式为10-1-3=6,故E为S元素,则B为Mg、F为Cl;(1)中D可用于半导体材料,则D为Si,据此解答.
解答 解:A、B、C、D、E、F为原子序数依次增大的短周期主族元素,A、C、E三种元素原子的最外层共有10个电子,三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,应是氢氧化铝与强碱、强酸的反应,则A为Na,C为Al,E原子最外层电子式为10-1-3=6,故E为S元素,则B为Mg、F为Cl;(1)中D可用于半导体材料,则D为Si.
(1)B为Mg元素,在元素周期表中的位置是:第三周期第ⅡA族,D可用于半导体材料,其元素符号是 Si,
故答案为:第三周期第ⅡA族;Si;
(2)E、F两元素的最高价氧化物的水化物分别为H2SO4、HClO4,应用Cl元素非金属性强于硫,故HClO4的酸性较强,
故答案为:HClO4;
(3)A为Na元素,原子结构示意图是 ,A和E元素形成的化合物为Na2S,含有离子键,
,A和E元素形成的化合物为Na2S,含有离子键,
故答案为: ;离子键;
;离子键;
(4)A、C、F的最高价氧化物对应水化物分别为NaOH、Al(OH)3、HClO4,Al(OH)3具有两性,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O;
(5)A元素的原子与氧原子按1:1的个数比形成的化合物为Na2O2,与二氧化碳反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,11.7gNa2O2的物质的量为$\frac{11.7g}{78g/mol}$=0.15mol,反应中过氧化钠其氧化剂、还原剂作用,各占一半,故转移电子为0.15mol×$\frac{1}{2}$×2×[0-(-1)]=0.15mol,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;0.15;
(6)由H、N、O三种元素组成的离子化合物X为NH4NO3,40gX的物质的量为$\frac{40g}{80g/mol}$=0.5mol,11.2L(标准状况)Y的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,设氮元素的氧化物为NxOy,即0.5molNH4NO3分解生成0.5molNxOy和1molH20,由氮原子守恒可知0.5mol×2=0.5mol×x,解得x=2,由氧原子守恒可知,0.5mol×3=0.5mol×y+1mol,解得y=1,即氧化物为N2O,
故答案为:N2O.
点评 本题考查结构性质位置关系应用,题目难度中等,推断元素是解题的关键,注意对元素化合物知识的掌握,(6)为易错点、难点,判断X为硝酸铵,再利用原子守恒解答.

 名校课堂系列答案
名校课堂系列答案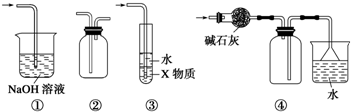
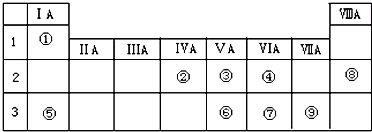
| A. | 装置①可用于吸收实验中多余的SO2 | |
| B. | 装置②可用于收集H2、NH3、Cl2、NO2等 | |
| C. | 装置③中X为苯,可用于吸收氨气或氯化氢 | |
| D. | 装置④可用于收集NH3,并吸收多余的NH3 |
| 主族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅤⅡA | O |
| 2 | b | h | c | |||||
| 3 | d | i | g | j | e | a | ||
| 4 | f |
(2)a原子结构示意图为
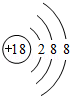 ;
;(3)与a的电子层结构相同的3种简单离子的半径有小到大的顺序是Ca2+<Cl-<S2-(填离子符号);
(4)g是带来人类文明的重要元素之一,其氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(5)c、d的单质在加热条件下生成物质X,其中含有化学键的类型为离子键、共价键;该物质中阴离子与阳离子个数比1:2.
(6)写出一个由其中某种元素的最高价氧化物对应的水化物与其最低价氢化物反应生成的化合物的化学反应方程式:NH3+HNO3=NH4NO3.
| A. | Ne | B. | F- | C. | Na+ | D. | K+ |
| 选项 | 操作 | 现象 | 结论 |
| A | 将饱和FeCl3溶液滴入沸水中 | 溶液变红褐色 | 有Fe(OH)3生成 |
| B | 向Na2S溶液中滴加盐酸 | 产生气泡 | Cl的非金属性比S强 |
| C | 向溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中含有SO42- |
| D | 用导线连接铜片和锌片后插进盐酸中 | 铜片上有气泡 | 铜片是原电池的正极 |
| A. | A | B. | B | C. | C | D. | D |
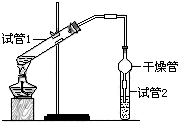 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在实
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在实验室制备乙酸乙酯反应中起催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下四个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管2,再测有机层的厚度,实验记录如下:
| 实验 编号 | 试管1中的试剂 | 试管2中试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和碳酸钠溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(2)干燥管在上述实验中的作用冷凝,防倒吸.
(3)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是6mL和6mol/L.
(4)分析实验AC(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸可以吸收产物中的水,使平衡向生成乙酸乙酯方向移动.
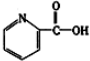 ②阿斯匹林
②阿斯匹林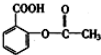
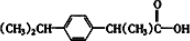 ④东茛菪内酯
④东茛菪内酯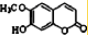
 ;
; .
.