题目内容
【题目】铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
I、铁矿石中含氧量的测定
①按下图组装仪器,检查装置的气密性;
②将 10.0g 铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③从左端导气管口处不断地通入 H2,______,点燃 A 处酒精灯;
④……
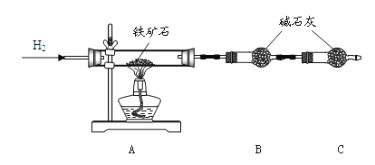
(1)装置 C 的作用为_______________________________________ 。
(2)将步骤③的操作补充完整:_________。
(3)实验结束后的操作包括: a.冷却至室温 b.熄灭 A 处的酒精灯 c.停止通 H2。正确的顺序为:_________(填序号)。
(4)实验测得反应后装置 B增重 2.7g,据此可以测出铁矿石中氧的含量。有同学认为,不测定 B 装置的净增质量,通过测定_________,也能达到实验目的。
II、铁矿石中含铁量的测定
将上述实验结束后硬质玻璃管中的固体全部取出,用足量稀硫酸浸取后过滤。向滤液中通入足量Cl2 并加热煮沸得溶液 M,冷却后将溶液 M 稀释至 250mL。取 20.00mL M 的稀溶液,用 0.5000mol·L-1的标准 KI 溶液与其反应,消耗 KI 溶液 20.00 mL。
(5)向滤液中通入足量 Cl2 的目的是将其中的 Fe2+氧化成 Fe3+。将通入 Cl2 后的溶液加热煮沸的目的则是_________。 若省去该操作,则所测铁的百分含量将_________。(填“偏大”, “偏小”或“无影响”)。
(6)标准 KI 溶液与 M 稀溶液发生反应的离子方程式为:_________。
III、化学式的确定
(7)结合 I、 II 的实验数据计算该铁矿石中铁的氧化物的化学式为_________。 (请化成最简单的整数比)
【答案】 防止空气中的水蒸气和 CO2 等进入 B 中,影响测定结果 在 C 装置的末端导管口收集氢气并验纯,待氢气纯净后 bac 硬质玻璃管在反应前后的质量差 赶走溶液中溶解的过量的 Cl2 偏大 2Fe3++2I-==2Fe2+ + I2 Fe5O6
【解析】Ⅰ.(1)B中的碱石灰是吸收置换反应生成的水的,为了防止空气成分对实验的影响,要加一个装置吸收空气中的水以及二氧化碳;(2)氢气验纯以后才能实验;(3)防止有空气干扰,先通一会氢气再加热,实验后先停止加热再停止通氢气;(4)硬质玻璃管在反应前后的质量差为氧化物中氧元素的质量;
II.(5)加热赶走溶液中溶解的过量的 Cl2;多余的氯气会氧化I-,使测定结果偏大;(6)Fe3+与KI发生氧化还原反应,离子方程式为:2Fe3++2I-==2Fe2++I2。(7)结合 I、 II 的实验数据,求出N(Fe):N(O),可得化学式。
Ⅰ.(1)由题意可知,该装置要定量测量反应产生的水来计算该氧化物的组成,碱石灰用来吸收产物水,但空气中含有水蒸气和二氧化碳,为了消除干扰,在反应装置末端增加的装置C,用来吸收空气中的二氧化碳和水蒸气,避免其影响测定结果。故答案为:防止空气中的水蒸气和 CO2 等进入 B 中,影响测定结果。
(2)步骤③从左端导气管口处不断地通入H2,在 C 装置的末端导管口收集氢气并验纯,待氢气纯净后,点燃 A 处酒精灯,故答案为:在 C 装置的末端导管口收集氢气并验纯,待氢气纯净后。
(3)实验结束后要先熄灭A 处的酒精灯,冷却至室温,再停止通 H2。故正确答案为:bac。 (4)根据实验原理,实验后硬质玻璃管减少的质量,既为氧化物中氧元素的质量,通过测定硬质玻璃管在反应前后的质量差,也能测出氧元素的含量。故答案为:硬质玻璃管在反应前后的质量差。
Ⅱ.(5)步骤③通入了足量的氯气,步骤④加热煮沸赶走溶液中多余的氯气。故答案为:赶走溶液中溶解的过量的 Cl2;若省去该操作,多余的氯气会氧化I-,使所测铁的百分含量将偏大。
(6) M 稀溶液含有Fe3+,与KI发生反应的离子方程式为:2Fe3++2I-==2Fe2+ + I2 。
(7)KI溶液滴定Fe3+的离子方程式为2Fe3++2I-==2Fe2+ + I2,消耗的n(I-)=0.5000mol/L![]() L,则20mL待测液中铁离子的物质的量0.5000mol/L
L,则20mL待测液中铁离子的物质的量0.5000mol/L![]() L,250mL待测液中n(Fe3+)=0.5000mol/L
L,250mL待测液中n(Fe3+)=0.5000mol/L![]() L
L ![]() =0.125mol;
=0.125mol;
实验I测得反应后装置B增重2.7g,根据反应的实质,增加的是水的质量,根据质量守恒定律,所以铁矿石中氧的物质的量是:![]() =0.15mol。
=0.15mol。
N(Fe):N(O)=0.125mol:0.15mol=5:6,故化学式为Fe5O6。

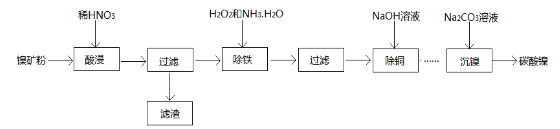
【题目】活性氧化锌(ZnO)粒径介于1-100 nm之间,是一种面向21世纪的新型高功能精细无机产品,表现出许多特殊的性质。某研究所以粗氧化锌(含少量CuO、FeO、MnO、Fe2O3等)为原料,采用湿化学法(NPP-法)制备纳米级活性氧化锌,生产工艺流程如图:
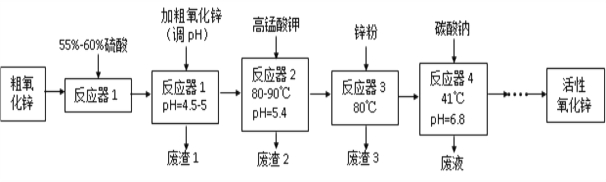
已知:
①pH=5.4时,KMnO4的还原产物为MnO2。
②以上实验条件下各种氢氧化物沉淀的pH情况如下表所示。
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
开始沉淀的pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
沉淀完全的pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
根据以上信息,回答下列问题:
(1)工艺过程中各步骤均用到的分离方法是_______________________________。
(2)“废渣1”的主要成分是______________________________________________。
(3)“反应器2”中两个氧化还原反应的离子方程式为_______________________________________________________________
(4) “反应器3”中加入锌粉的作用是________________________________。
(5)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有______________。
【题目】变量控制是科学研究的重要方法。相同质量的碳酸钙与足量1 mol·L-1盐酸分别在下列条件下发生反应,化学反应速率最大的是
选项 | 碳酸钙的状态 | 实验温度/℃ |
A | 粉末 | 10 |
B | 粉末 | 30 |
C | 块状 | 10 |
D | 块状 | 30 |
A.AB.BC.CD.D
【题目】(1)在2L恒容密闭容器中,发生反应2NO(g)+O2(g)2NO2(g).
①某温度时,按物质的量比2:1充入NO和O2开始反应,n(NO)随时间变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.007 | 0.006 | 0.006 | 0.006 |
0~4s内以O2浓度变化表示的反应速率为________.
②能说明该反应已达到平衡状态的是________.
A.气体颜色保持不变 B.气体平均相对分子质量保持不变
C.υ正(NO)=2υ正(O2) D.气体压强保持不变
③已知:K300℃>K400℃.下列措施能使该反应的反应速率增大且平衡向正反应方向移动的是_______.
A、升高温度 B、充入Ar使压强增大
C、选择高效催化剂 D、充入NO使压强增大
(2)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml 1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).

①甲烷燃料电池的负极反应式:____________________________________________.
②电解后溶液的pH=________(忽略氯气与氢氧化钠溶液反应).
(3)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题:

①下列3个反应中符合示意图描述的反应的是 ___________(填代号).
A、铝粉与Fe2O3反应 B、用水稀释浓硫酸溶液 C、灼热的碳与CO2反应
②以甲烷为原料制取氢气是工业上常用的制氢方法.已知:
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+306kJ/mol
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+240kJ/mol
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为_______________________.