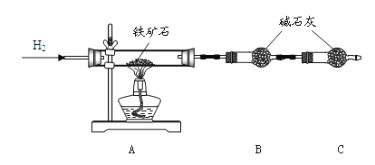
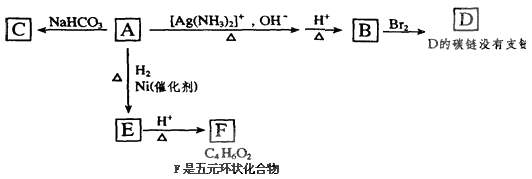
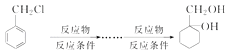
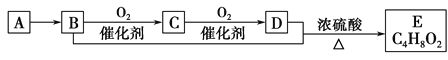
题目内容
【题目】以镍矿粉(主要成分为NiS,杂质FeS、CuS和SiO2等)为原料可制备NiCO3
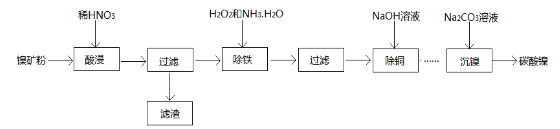
已知Ni和Fe为变价金属,常见化合价为+2价、+3价。
(1)在酸浸过程中,CuS与稀HNO3反应生成淡黄色固体,其离子方程式为___________________,滤渣的主要成分为________________________;
(2)在除FeS时,需加入过量的H2O2氧化,若用过强的氧化剂,其可能的后果是_______________;反应完全后,除去多余H2O2的简便方法是______________________;
(3)在“沉镍”工艺中,若将含Ni2+溶液缓慢加入至盛有Na2CO3溶液的反应容器中,可能会形成杂质,其原因是_______________________(用离子方程式表示)。检验碳酸镍沉淀完全的方法是__________________;
【答案】 3CuS+8H++2NO3-=3Cu2++2NO↑+4H2O SiO2 NiCO3中可能混有Ni2(CO3)3 煮沸(或加热) CO32-+H2O![]() HCO3-+OH-,Ni2++2OH-=Ni(OH)2或合并书写 静置,向上层清液中继续滴加Na2CO3溶液,若不再产生沉淀,则说明碳酸镍沉淀完全
HCO3-+OH-,Ni2++2OH-=Ni(OH)2或合并书写 静置,向上层清液中继续滴加Na2CO3溶液,若不再产生沉淀,则说明碳酸镍沉淀完全
【解析】试题分析:(1)CuS与稀HNO3反应生成淡黄色固体,说明生成S单质;NiS、FeS、CuS和SiO2只有SiO2不与硝酸反应;(2)强氧化剂能把Ni2+氧化为Ni3+;H2O2加热易分解;(3)碳酸钠水解溶液显碱性,Ni2+与OH-反应生成Ni(OH)2沉淀;继续滴加Na2CO3溶液,若不再产生沉淀,则说明碳酸镍沉淀完全。
解析:(1)CuS与稀HNO3反应生成淡黄色固体,说明生成S单质,反应的离子方程式为3CuS+8H++2NO3-=3Cu2++2NO↑+4H2O;NiS、FeS、CuS和SiO2只有SiO2不与硝酸反应,所以滤渣的主要成分为SiO2;(2)强氧化剂能把Ni2+氧化为Ni3+,若用过强的氧化剂,其可能的后果是NiCO3中可能混有Ni2(CO3)3杂质;H2O2加热易分解,除去多余H2O2的简便方法是煮沸;(3)碳酸钠水解溶液出碱性CO32-+H2O![]() HCO3-+OH-,Ni2+与OH-反应生成Ni(OH)2沉淀Ni2++2OH-=Ni(OH)2;检验碳酸镍沉淀完全的方法是静置、向上层清液中继续滴加Na2CO3溶液,若不再产生沉淀,则说明碳酸镍沉淀完全。
HCO3-+OH-,Ni2+与OH-反应生成Ni(OH)2沉淀Ni2++2OH-=Ni(OH)2;检验碳酸镍沉淀完全的方法是静置、向上层清液中继续滴加Na2CO3溶液,若不再产生沉淀,则说明碳酸镍沉淀完全。

 阅读快车系列答案
阅读快车系列答案