题目内容
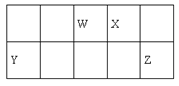
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是
A. 氢化物热稳定性:W<X
B. 最高价氧化物对应水化物的酸性:W<Y
C. Z、W的氢化物的水溶液都呈酸性
D. 简单离子的半径:Y>Z
【答案】A
【解析】根据四种元素在周期表中的位置,W、X在第二周期,Y、Z在第三周期,设Y的最外层电子数为a,则W、X、Z的最外层电子数依次为a+2、a+3、a+4,a+a+2+a+3+a+4=21,解得a=3;W、X、Y、Z依次为N、O、Al、Cl元素。
根据四种元素在周期表中的位置,W、X在第二周期,Y、Z在第三周期,设Y的最外层电子数为a,则W、X、Z的最外层电子数依次为a+2、a+3、a+4,a+a+2+a+3+a+4=21,解得a=3;W、X、Y、Z依次为N、O、Al、Cl元素。A项,非金属性W(N)![]() X(O),氢化物的热稳定性:W
X(O),氢化物的热稳定性:W![]() X,A项正确;B项,非金属性:W(N)
X,A项正确;B项,非金属性:W(N)![]() Y(Al),最高价氧化物对应水化物的酸性W
Y(Al),最高价氧化物对应水化物的酸性W![]() Y,B项错误;C项,Z、W的氢化物依次为HCl、NH3,HCl的水溶液呈酸性,NH3的水溶液呈碱性,C项错误;D项,根据“层多径大”,简单离子半径Y
Y,B项错误;C项,Z、W的氢化物依次为HCl、NH3,HCl的水溶液呈酸性,NH3的水溶液呈碱性,C项错误;D项,根据“层多径大”,简单离子半径Y![]() Z,D项错误;答案选A。
Z,D项错误;答案选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目