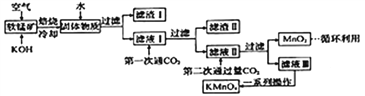
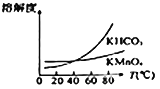
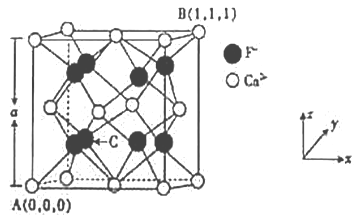
��Ŀ����
����Ŀ�����ǵڶ�����VA��Ԫ�أ��γɵ�[Cu(NH3)4](OH)2��N2H4��NH3�ȶ��ֺ������������ų�֮����;���ش��������⣬
(1)��������ԭ�ӽṹʾ��ͼ��___________��
(2)�Ʊ�ͭ����Һ�ķ����ж��֣�����һ�ֵķ�Ӧԭ��Ϊ��Cu(OH)2(s)+2NH3��H2O+ 2NH4+![]() [Cu(NH3)4]2+ (����ɫ)+ 4H2O.��ʢ������Cu(OH)2������Թ��м���14 mol/L�İ�ˮ���õ�����Һ����ʱ����������������粒��壬������Ӧ������Ϊ________����ԭ����__________��
[Cu(NH3)4]2+ (����ɫ)+ 4H2O.��ʢ������Cu(OH)2������Թ��м���14 mol/L�İ�ˮ���õ�����Һ����ʱ����������������粒��壬������Ӧ������Ϊ________����ԭ����__________��
(3)��(N2H4)�ֳ���������������һ�ֿ�ȼ��Һ�壬��ȼ���Ƚϴ��Ҳ���Ի�������Ⱦ�����������ȼ�ϡ�
��֪:N2(g)+O2(g)=2NO(g) ��H1;
2NO(g)+O2(g)=2NO2(g) ��H2;
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ��H3;
��Ӧ:N2H4(g)+O2(g)=N2(g)+2H2O ��H=_____(�ú���H1����H2����H3�Ĵ���ʽ��ʾ)��
(4)ij�¶��£��ֱ����������Ϊ20L���ܱ������г���1molN2��2.6molH2�ֱ𱣳ֺ��º��ݡ����º�ѹ�;��Ⱥ��ݣ���������Ӧ:N2(g)+3H2(g)![]() 2NH3(g) ��H<0����������(�ֱ���a��b��c��ʾ)��N��ת����(��)�뷴Ӧʱ��(t)�Ĺ�ϵ��ͼ��ʾ��
2NH3(g) ��H<0����������(�ֱ���a��b��c��ʾ)��N��ת����(��)�뷴Ӧʱ��(t)�Ĺ�ϵ��ͼ��ʾ��

�����б�ʾ����ʱ��Ӧ�Ѵﵽƽ��״̬����______ (����ĸ)
A.������Ũ�Ȳ��ٱ仯
B.x(H2)=3v(N2)
C.c(N2)/c(NH3)��ֵ���ٱ仯
D.��(N2)=16.7%
��ͼ�д�����Ӧ�ھ��Ⱥ��������н��е�������______(�a����b����c��)��
��b�����У�M��v��_____(����ڡ���С�ڡ����ڡ�)v�档
������a�����������¸÷�Ӧ��ƽ�ⳣ��K=__________��
���𰸡� ![]() �����ܽ�,�õ�����ɫ��Һ ��������粒���,������NH4+��Ũ��,ʹ����ƽ��������ͭ�����ӵķ����ƶ� 1/2(��H1+��H2+��H3) AC c ���� 10
�����ܽ�,�õ�����ɫ��Һ ��������粒���,������NH4+��Ũ��,ʹ����ƽ��������ͭ�����ӵķ����ƶ� 1/2(��H1+��H2+��H3) AC c ���� 10
��������(1)��Ϊ7��Ԫ�أ���ԭ�ӽṹʾ��ͼΪ��![]() ��(2) �Ʊ�ͭ����Һ�ķ����ж��֣�����һ�ֵķ�Ӧԭ��Ϊ��Cu(OH)2(s)+2NH3��H2O+ 2NH4+
��(2) �Ʊ�ͭ����Һ�ķ����ж��֣�����һ�ֵķ�Ӧԭ��Ϊ��Cu(OH)2(s)+2NH3��H2O+ 2NH4+![]() [Cu(NH3)4]2+ (����ɫ)+ 4H2O.��ʢ������Cu(OH)2������Թ��м���14 mol/L�İ�ˮ���õ�����Һ����ʱ����������������粒��壬������Ӧ������Ϊ�����ܽ�,�õ�����ɫ��Һ����ԭ���Ǽ�������粒���,������NH4+��Ũ��,ʹ����ƽ��������ͭ�����ӵķ����ƶ���(3)��֪:��N2(g)+O2(g)=2NO(g) ��H1;
[Cu(NH3)4]2+ (����ɫ)+ 4H2O.��ʢ������Cu(OH)2������Թ��м���14 mol/L�İ�ˮ���õ�����Һ����ʱ����������������粒��壬������Ӧ������Ϊ�����ܽ�,�õ�����ɫ��Һ����ԭ���Ǽ�������粒���,������NH4+��Ũ��,ʹ����ƽ��������ͭ�����ӵķ����ƶ���(3)��֪:��N2(g)+O2(g)=2NO(g) ��H1;
��2NO(g)+O2(g)=2NO2(g) ��H2;
��2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ��H3;
���ݸ�˹���ɣ���![]() �÷�Ӧ:N2H4(g)+O2(g)=N2(g)+2H2O ��H=
�÷�Ӧ:N2H4(g)+O2(g)=N2(g)+2H2O ��H=![]() (��H1+��H2+��H3)��(4) ��A.������Ũ�Ȳ��ٱ仯��˵����Ӧ�Ѵ�ƽ��״̬��ѡ��A��ȷ��B.û��˵�����淴Ӧ���ʣ���Ӧһ��ʼ��һֱ��v(H2)=3v(N2)���ֹ�ϵ���У���˵����Ӧ��ƽ��״̬��ѡ��B����C.c(N2)/c(NH3)��ֵ���ٱ仯�������Ӧ���Ũ�Ȳ��ٱ仯����Ӧ�ﵽƽ��״̬��ѡ��C��ȷ��D.��(N2)=16.7%��û��˵�����ĸ������ķ�Ӧ����һ���ﵽƽ��״̬��ѡ��D����ѡAC���ڷ�Ӧ:N2(g)+3H2(g)
(��H1+��H2+��H3)��(4) ��A.������Ũ�Ȳ��ٱ仯��˵����Ӧ�Ѵ�ƽ��״̬��ѡ��A��ȷ��B.û��˵�����淴Ӧ���ʣ���Ӧһ��ʼ��һֱ��v(H2)=3v(N2)���ֹ�ϵ���У���˵����Ӧ��ƽ��״̬��ѡ��B����C.c(N2)/c(NH3)��ֵ���ٱ仯�������Ӧ���Ũ�Ȳ��ٱ仯����Ӧ�ﵽƽ��״̬��ѡ��C��ȷ��D.��(N2)=16.7%��û��˵�����ĸ������ķ�Ӧ����һ���ﵽƽ��״̬��ѡ��D����ѡAC���ڷ�Ӧ:N2(g)+3H2(g)![]() 2NH3(g) ��H<0Ϊ���������С�ķ��ȷ�Ӧ����ʼͶ��Ϊ����������������º�ѹ��Ӧ�������������С�൱������ѹǿ��ƽ������������У�������ת�������Ϊa����Ӧ���ȣ����Ⱥ�����ϵ�¶����ߣ�����º��ݱ�ƽ�����淴Ӧ�����ƶ���������ת���ʽ��ͣ�Ϊc����b�����У�M�㷴Ӧ��û��ƽ�⣬��������������У�v������v�棻�ܶ���ͬһ��Ӧ���¶���ͬ��ƽ�ⳣ����ͬ��������a�����������¸÷�Ӧ��ƽ�ⳣ��K������b����ͬ��b�е�����ƽ��ת����Ϊ20%,��
2NH3(g) ��H<0Ϊ���������С�ķ��ȷ�Ӧ����ʼͶ��Ϊ����������������º�ѹ��Ӧ�������������С�൱������ѹǿ��ƽ������������У�������ת�������Ϊa����Ӧ���ȣ����Ⱥ�����ϵ�¶����ߣ�����º��ݱ�ƽ�����淴Ӧ�����ƶ���������ת���ʽ��ͣ�Ϊc����b�����У�M�㷴Ӧ��û��ƽ�⣬��������������У�v������v�棻�ܶ���ͬһ��Ӧ���¶���ͬ��ƽ�ⳣ����ͬ��������a�����������¸÷�Ӧ��ƽ�ⳣ��K������b����ͬ��b�е�����ƽ��ת����Ϊ20%,��
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
��ʼʱ��Ũ��(mol/L) 0.05 0.13 0
�ı��Ũ��(mol/L) 0.01 0.03 0.02
ƽ��ʱ��Ũ��(mol/L) 0.04 0.10 0.02
ƽ�ⳣ��![]() ��
��

 �������ͬ����ϰϵ�д�
�������ͬ����ϰϵ�д�����Ŀ��r��Fe2O3��һ�־��д��ԡ��������������ײ��ϡ�һ����������������Ϊԭ���Ʊ�r��Fe2O3���������£�

(1)�����йء���ԭ���ա������˵����ȷ����_____(����ĸ)��
a.��̿Ӧ����������Ӧ����
b. ���չ��̾�Ϊ���ȷ�Ӧ�����õ�¯�������ȷ�Ӧ��
c.����ԭ���ա�����Ҫ��ӦΪ 3C+2O2![]() 2CO+CO2��Fe2O3+CO
2CO+CO2��Fe2O3+CO![]() 2FeO+CO2
2FeO+CO2
(2)����ȡ��ǰ�轫�������ɵ�������飬��Ŀ����_____________________��
(3)��֪���ֽ������ӿ�ʼ��������ȫ������pH���±���
Fe3+ | Fe2+ | Al3+ | |
��ʼ������pH | 2.2 | 7.5 | 4.1 |
��ȫ������pH | 3.5 | 9.5 | 5.4 |
��pH��ʱ����Һ��pH��ΧΪ_______________��
(4)����1����Ҫ�ɷ�Ϊ_________(�ѧʽ)����������ʱ������Ӧ�����ӷ���ʽΪ___________��
(5)������2��ʱ��������ˮϴ�ӣ���֤��������ϴ�Ӹɾ��ķ�����_________��������������Ϊ���ƵĻ�ѧ����ʽΪ________________��
����Ŀ��I. �����£���3��һԪ��ֱ��NaOH��Һ�������ϣ�ʵ���������£�
��� | c��һԪ�ᣩ��c��H+�� | c��NaOH����mol/L | �����Һ��pH |
�� | c��H+��=0.1 mol��L��HX�� | 0.1 | pH=a |
�� | c��HY��=0.1mol��L | 0.1 | pH=7 |
�� | c��HZ��=0.1 mol��L | 0.1 | pH=9 |
��1������ʵ����HXΪ���ᣬa______7���<������=����>������
��2������ʵ����HY��Һ��pH=______��
��3������ʵ�鷢����Ӧ�����ӷ���ʽΪ__________________��
������Һ����ˮ�������c��OH-��=______mol/L��
II. ��0.1 mol��L-1 NaOH��Һ�ֱ���������Ϊ20 mL��Ũ�Ⱦ�Ϊ0.1 mol��L-1 HCl��Һ��HA��Һ����Һ��pH�����NaOH��Һ����仯��ͼ��
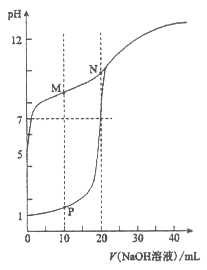
��1��HAΪ_______�ᣨ�ǿ������������
��2��N��pH>7��ԭ���ǣ������ӷ���ʽ��ʾ��_________��
��3������˵����ȷ����_______ ������ĸ����
a. M��c��HA��-��
b. M��c��Na+��>c��OH-��
c. P��c��Cl-��=0.05 mol��L-1
��4��NaA��NaOH��Ũ�ȵ�������ʱ����Һ��c��A-��______c��OH-�����<������=����>����