题目内容
下列各组微粒的空间构型相同的是( )
①NH3和H2O ②NH 和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和C2H2 ⑥SiO
和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和C2H2 ⑥SiO 和SO
和SO
| A.全部 | B.除①④⑥以外 | C.③④⑤⑥ | D.②⑤⑥ |
C
解析试题分析:氨气是三角锥形,水是V形,①不正确;铵根离子是正四面体形,水合氢离子是三角锥形,②不正确;氨气和水合氢离子均是三角锥形,③正确;臭氧和二氧化硫均是V形,④正确;CO2和C2H2均是直线形,⑤正确;SiO 和SO
和SO 均是正四面体形,⑥正确,答案选C。
均是正四面体形,⑥正确,答案选C。
考点:考查分子空间构型的判断

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列物质中σ键和π键数目比为1 :2的是
| A.O2 | B.HCN | C.CO2 | D.N2 |
下列叙述不正确的是( )
| A.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键 |
| B.向煤中加入生石灰可减少对大气的污染 |
| C.完全由非金属元素组成的化合物可以形成离子化合物 |
| D.由氮气为原料合成氨是氮的固定 |
下列说法不正确的是
| A.在共价化合物中一定含有共价键 |
| B.含有离子键的化合物一定是离子化合物 |
| C.含有共价键的化合物一定是共价化合物 |
| D.化学反应过程中,反应物分子内的化学键断裂,产物分子的化学键形成 |
下列叙述中正确的是
| A.离子化合物熔融状态下一定导电 |
| B.金属元素跟非金属元素化合时都能形成离子键 |
| C.离子化合物中的阳离子只能是金属离子,酸根离子中不能含有金属元素 |
| D.离子化合物中不一定含有离子键,含共价键的化合物不一定是共价化合物 |
下列推断正确的是 ( )
| A.BF3是三角锥形分子 |
B.NH 的电子式: 的电子式: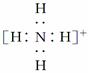 ,离子呈平面形结构 ,离子呈平面形结构 |
| C.CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键 |
| D.CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个s-sp3 σ键 |
下列物质中不含共价键的是
| A.H2 | B.NaCl | C.KOH | D.H2S |
下列关于化合物的说法正确的是:
| A.只含有共价键的物质一定是共价化合物 |
| B.由两种原子组成的纯净物一定是化合物 |
| C.熔化后不导电的化合物一定是共价化合物 |
| D.不含非极性键的化合物一定是共价化合物 |
下列晶体或分子中,含有化学键类型有差异的一组是
| A.NH3、NO2。 | B.NaCl、KF |
| C.NaOH、Ca(OH)2 | D.MgO、H2O2 |