题目内容
下列叙述不正确的是( )
| A.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键 |
| B.向煤中加入生石灰可减少对大气的污染 |
| C.完全由非金属元素组成的化合物可以形成离子化合物 |
| D.由氮气为原料合成氨是氮的固定 |
A
解析试题分析:A、固态稀有气体为分子晶体,不含化学键,错误;B、CaO能与煤燃烧时产生的污染气体SO2反应,可减少对大气的污染,正确;C、完全由非金属元素组成的化合物可以形成离子化合物,如NH4Cl等铵盐,正确;D、游离态的氮元素转化为化合态为氮的固定,所以由氮气为原料合成氨是氮的固定,正确。
考点:本题考查物质结构、物质的性质。

练习册系列答案
相关题目
下列表述不正确的是( )
| A.131I与127I互为同位素,化学性质几乎相同 |
| B.pm 2. 5含有铅、镉、铬、钒等对人体有害的金属元素 |
| C.除去SO2中混有的少量HCl,使气体通过盛有饱和NaHSO3溶液的洗气瓶 |
| D.为了证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性 |
下列对σ键的认识不正确的是
| A.ss σ键与sp σ键的对称性相同 |
| B.烯烃分子中的碳碳双键的键能是碳碳单键键能的二倍 |
| C.分子中含有共价键,则至少含有一个σ键 |
| D.含有π键的化合物与只含σ键的化合物的化学性质不同 |
下列说法正确的是
| A.冰熔化时,分子中H—O键发生断裂 |
| B.NaOH中只含有离子键 |
| C.CO2与SiO2都属于分子晶体 |
| D.熔沸点由高到低的顺序是金刚石>NaCl>I2 |
下列变化中,吸收的热量用于克服分子间作用力的是
| A.加热金属铝使之熔化 |
| B.加热金刚石使之熔化 |
| C.液溴受热变成溴蒸气 |
| D.加热碘化氢使之分解 |
下列各组微粒的空间构型相同的是( )
①NH3和H2O ②NH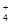 和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和C2H2 ⑥SiO
和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和C2H2 ⑥SiO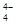 和SO
和SO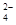
| A.全部 | B.除①④⑥以外 | C.③④⑤⑥ | D.②⑤⑥ |
表中原子化热、晶格能、键能的单位都是kJ·mol-1
| 金属 | 金属原子化热 | 离子化合物 | 晶格能 | 共价键 | 键能 |
| Na | 108.4 | NaCl | 786 | Cl-Cl | 243 |
| Mg | 146.4 | NaBr | 747 | Si-Si | 176 |
| Al | 326.4 | MgO | 3791 | Si-Cl | 360 |
A.Na(s)与Cl2(g)反应生成1molNaCl(s)放出的热量为556.1kJ
B.Si(s)+2Cl2(g)=SiCl4(g) △H= - 602kJ·mol-1
C.从表中可以看出,氯化钠的熔点比晶体硅高
D.从表中数据可以看出,微粒半径越大金属键、离子键的越弱,而共价键却越强
