题目内容
下列关于化合物的说法正确的是:
| A.只含有共价键的物质一定是共价化合物 |
| B.由两种原子组成的纯净物一定是化合物 |
| C.熔化后不导电的化合物一定是共价化合物 |
| D.不含非极性键的化合物一定是共价化合物 |
C
解析试题分析:A、只含有共价键的物质可能是单质,错误;B.由两种原子组成的纯净物如:16O于18O形成的氧气,错误;D、不含非极性键的化合物不一定是共价化合物,如NaOH。
考点:共价化合物的组成和结构的特点。

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
下列对σ键的认识不正确的是
| A.ss σ键与sp σ键的对称性相同 |
| B.烯烃分子中的碳碳双键的键能是碳碳单键键能的二倍 |
| C.分子中含有共价键,则至少含有一个σ键 |
| D.含有π键的化合物与只含σ键的化合物的化学性质不同 |
下列各组微粒的空间构型相同的是( )
①NH3和H2O ②NH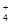 和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和C2H2 ⑥SiO
和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和C2H2 ⑥SiO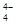 和SO
和SO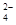
| A.全部 | B.除①④⑥以外 | C.③④⑤⑥ | D.②⑤⑥ |
下列结构中,从成键情况看,不合理的是
A. | B.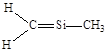 | C.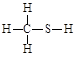 | D.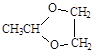 |
下列物质中含有共价键的离子化合物是( )
| A.Ba(OH)2 | B.CaCl2 | C.H2O | D.H2 |
下列各组中的分子,全部是以极性键形成非极性分子的是
| A.H2、N2、Cl2 | B.CH4、NH3、H2O |
| C.HCl、NO、Br2 | D.CO2、CS2、CCl4 |
表中原子化热、晶格能、键能的单位都是kJ·mol-1
| 金属 | 金属原子化热 | 离子化合物 | 晶格能 | 共价键 | 键能 |
| Na | 108.4 | NaCl | 786 | Cl-Cl | 243 |
| Mg | 146.4 | NaBr | 747 | Si-Si | 176 |
| Al | 326.4 | MgO | 3791 | Si-Cl | 360 |
A.Na(s)与Cl2(g)反应生成1molNaCl(s)放出的热量为556.1kJ
B.Si(s)+2Cl2(g)=SiCl4(g) △H= - 602kJ·mol-1
C.从表中可以看出,氯化钠的熔点比晶体硅高
D.从表中数据可以看出,微粒半径越大金属键、离子键的越弱,而共价键却越强
能用键能知识解释的是
| A.稀有气体的化学性质很不活泼 | B.HCl气体比HI气体稳定 |
| C.干冰易升华 | D.HF熔沸点高于HCl |
实验测得 BeCl2为共价化合物,两个Be—Cl键间的夹角为180°。由此可见,BeCl2属于( )
| A.由极性键构成的极性分子 | B.由极性键构成的非极性分子 |
| C.由非极性键构成的极性分子 | D.由非极性键构成的非极性分子 |