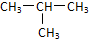题目内容
20.下列说法正确的是( )| A. | 氯化铵受热固体消失和干冰升华只需克服分子间作用力 | |
| B. | NaF、H2SO4中所含化学键类型相同 | |
| C. | HCl气体溶于水和NaOH熔化破坏的化学键类型相同 | |
| D. | I2、Br2、Cl2、F2 熔沸点逐渐降低 |
分析 A.氯化铵受热分解破坏离子键;
B.活泼金属与活泼非金属形成离子键,非金属之间形成共价键;
C.HCl中含有共价键,NaOH含有离子键和共价键;
D.分子晶体的相对分子质量越大,熔沸点越高.
解答 解:A.氯化铵属于离子晶体,氯化铵受热分解破坏离子键,干冰升华只需克服分子间作用力,故A错误;
B.活泼金属与活泼非金属形成离子键,则NaF中只有离子键,非金属之间形成共价键,H2SO4中只含有共价键,故B错误;
C.HCl中含有共价键溶于水破坏共价键,NaOH含有离子键和共价键,溶于水电离出钠离子和氢氧根离子,破坏离子键,故C错误;
D.分子晶体的相对分子质量越大,熔沸点越高,则I2、Br2、Cl2、F2 熔沸点逐渐降低,故D正确.
故选D.
点评 本题考查晶体类型及化学键,明确不同类型的晶体在熔化时克服不同的作用力是解答本题的关键,题目难度不大,注意把握晶体类型.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
20.元素的种类主要取决于( )
| A. | 质子数 | B. | 中子数 | C. | 电子数 | D. | 最外层电子数 |
8.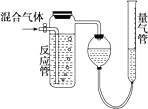 测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )
测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )
 测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )
测量SO2、N2、O2混合气体中SO2含量的装置如图,反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI.反应管内溶液蓝色消失后,没有及时停止通气.测得的SO2的体积分数( )| A. | 偏高 | B. | 偏低 | C. | 无影响 | D. | 无法确定 |
15.CuCl2常用于颜料、木材防腐等工业,并用作消毒剂、媒染剂、催化剂.工业上用粗制的氧化铜粉末(含FeO和SiO2杂质)来制取无色CuCl2的流程如下: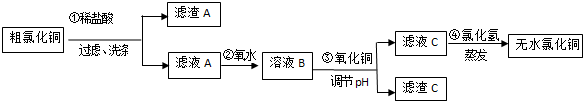
已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表
(1)第②步反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
(2)滤渣A的成分有SiO2(填化学式),检验滤液C中的Fe3+离子是否除尽的方法是取少量滤液C于试管中,向其中加入硫氰化钾溶液,溶液变血红色,证明滤液C中Fe3+未除尽,反之未除尽.
(3)第④步蒸发操作必要的仪器有铁架台(含铁圈)、坩埚钳、石棉网、酒精灯、蒸发皿、玻璃棒,需要在氯化氢气流中蒸干制取无水氯化铜的原因是氯化氢可抑制氯化铜的水解;
(4)称取30.250g已制得的无水CuCl2产品(含0.0204molFeCl3杂质),溶于水中,加入过量的铁粉充分反应后过滤.得250mL滤液,量取25.00mL滤液于锥形瓶中,用0.100mol•L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积平均为46.00mL,则该无水CuCl2产品中CuCl2的质量分数为0.89(用小数表示,计算结果保留2位小数).

已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表
| 离子符号 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 2.5 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.7 | 6.7 |
(2)滤渣A的成分有SiO2(填化学式),检验滤液C中的Fe3+离子是否除尽的方法是取少量滤液C于试管中,向其中加入硫氰化钾溶液,溶液变血红色,证明滤液C中Fe3+未除尽,反之未除尽.
(3)第④步蒸发操作必要的仪器有铁架台(含铁圈)、坩埚钳、石棉网、酒精灯、蒸发皿、玻璃棒,需要在氯化氢气流中蒸干制取无水氯化铜的原因是氯化氢可抑制氯化铜的水解;
(4)称取30.250g已制得的无水CuCl2产品(含0.0204molFeCl3杂质),溶于水中,加入过量的铁粉充分反应后过滤.得250mL滤液,量取25.00mL滤液于锥形瓶中,用0.100mol•L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积平均为46.00mL,则该无水CuCl2产品中CuCl2的质量分数为0.89(用小数表示,计算结果保留2位小数).
12.臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)?N2O5(g)+O2(g).若此反应在恒容密闭容器中进行,相关图象如下列选项,其中对应分析结论正确的是( )
| A. | B. | C. | D. |
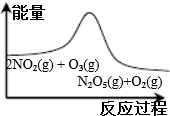 | 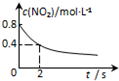 |  | 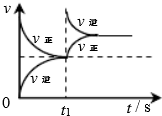 |
| 平衡后升温, NO2含量降低 | 0~2s内, v(O3)=0.2 mol•L-1•s-1 | V正:b点>a点 b点:v逆>v正 | 恒温,t1时再充入O3 |
| A. | A | B. | B | C. | C | D. | D |
10.下列物质间的反应,其能量变化符合如图的是( )
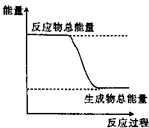

| A. | 灼热的碳和二氧化碳的反应 | B. | Ba (OH)2•8H2O晶体和NH4Cl晶体混合 | ||
| C. | 生石灰和水反应 | D. | CaCO3分解 |
 ,CaCl2
,CaCl2 ,NaOH
,NaOH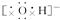 Na2O2
Na2O2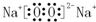 .
.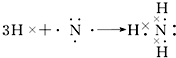 ;
;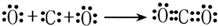 .
.