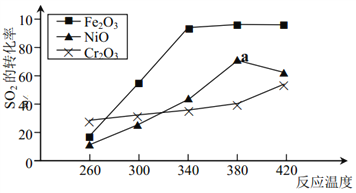
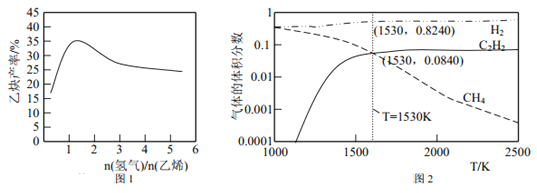
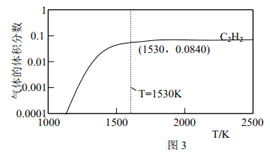
题目内容
【题目】工业上用铁矿石、焦炭、空气、石灰石为原料来冶炼铁。
(1)请写出用磁铁矿在高温下冶炼铁的化学方程式___________。请你用化学方法设计实验方案检验上述反应得到的固体产物中含有铁粉___________。
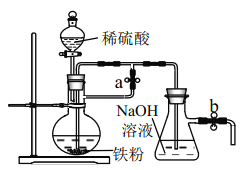
(2)小明同学将用冶炼所得的铁粉按下图装置来制备 Fe(OH)2,实验开始时应先_______活塞a,___________活塞 b(填“打开”或“关闭”)
【答案】 Fe3O4 +4CO![]() 3Fe+4CO2 方法 1:在黑色粉末中加入稀硫酸(稀盐酸),如果有气泡生成,则是铁粉;方法 2:在黑色粉末中加入硫酸铜溶液,如果黑色粉末表面有红色固体析出,则是铁粉 打开 打开
3Fe+4CO2 方法 1:在黑色粉末中加入稀硫酸(稀盐酸),如果有气泡生成,则是铁粉;方法 2:在黑色粉末中加入硫酸铜溶液,如果黑色粉末表面有红色固体析出,则是铁粉 打开 打开
【解析】(1)磁铁矿主要成分为Fe3O4,过量的碳与氧气高温下反应生成CO,Fe3O4被CO还原为Fe,化学方程式Fe3O4 +4CO![]() 3Fe+4CO2;正确答案:Fe3O4 +4CO
3Fe+4CO2;正确答案:Fe3O4 +4CO![]() 3Fe+4CO2 。反应后的生成物中一定含有铁粉,利用金属铁和稀硫酸反应放氢气或铁从硫酸铜溶液中置换出铜的性质就可以检验出生成物中是否含有金属铁;正确答案:方法 1:在黑色粉末中加入稀硫酸(稀盐酸),如果有气泡生成,则是铁粉;方法 2:在黑色粉末中加入硫酸铜溶液,如果黑色粉末表面有红色固体析出,则是铁粉 。
3Fe+4CO2 。反应后的生成物中一定含有铁粉,利用金属铁和稀硫酸反应放氢气或铁从硫酸铜溶液中置换出铜的性质就可以检验出生成物中是否含有金属铁;正确答案:方法 1:在黑色粉末中加入稀硫酸(稀盐酸),如果有气泡生成,则是铁粉;方法 2:在黑色粉末中加入硫酸铜溶液,如果黑色粉末表面有红色固体析出,则是铁粉 。
(2)Fe(OH)2还原性很强,易被空气中氧气氧化变为Fe(OH)3,因此在制备Fe(OH)2沉淀时,一定要避免空气的干扰;实验开始时应先排净装置内的空气,因此先打开活塞a和活塞b,利用铁和硫酸反应产生的氢气来实现此目的;然后关闭活塞a,就可以在锥形瓶中看到白色沉淀;正确答案: 打开; 打开。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案【题目】25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
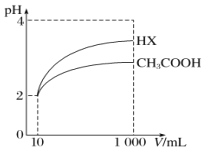
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)醋酸的电离平衡常数,理由是__________________。
【题目】亚硝酸(HNO2)为一元弱酸,其性质与硝酸相似。已知:298K时,四种物质的电离平衡常数(K)如下表。
HNO2 | NH3·H2O | H2CO3 | H2SO3 | |
K(mol·L-1)-2 | 5.1×10-4 | 1.8×10-5 | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10﹣2 Ka2=6.3×10﹣8 |
(1)下列不能说明HNO2是弱电解质的是_____。
A.常温下0.1 mol·L-1 NaNO2溶液的pH>7
B.用一定浓度HNO2溶液做导电实验,灯泡很暗
C.等pH、等体积的盐酸和HNO2溶液分别与足量锌反应,HNO2放出的氢气较多
D.常温下,0.1mol·L-1 HNO2溶液的pH=2.3
(2)298K时,将10mL 0.1mol·L-1的亚硝酸溶液与10mL 0.1mol·L-1氨水混合,所得溶液为_____(填“酸性”、“碱性”或“中性”),原因是___________________________。
(3)若将pH=2的HNO2、HCl两溶液分别加水稀释,pH变化如右图所示,判断曲线I对应的溶液为_______(填化学式)。图中a、b、c三点对应溶液的导电能力由强到弱的顺序是
________(用a、b、c表示,下同);溶液中水的电离程度由强到弱的顺序是________。

(4)依据提供数据回答下列问题。
①求298K时,NaHSO3溶液中HSO3-水解平衡常数Kh =____;由此可判断HSO3-水解程度______电离程度(填“>”、“<”或“=”)。
②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为______。
(5)298K时,向含有2mol Na2CO3的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是_______。