题目内容
【题目】如图所示,X是一种生活中常见的金属元素,A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间(实验中所有溶液均足量)。
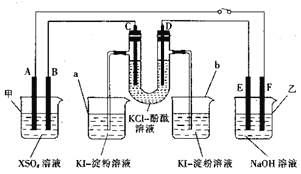
(1)甲池是___(填“原电池”或“电解池”,下同)装置;乙池是___装置。
(2)D极为___(填“阴极”或“阳极”)。
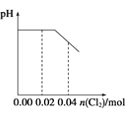
(3)烧杯中溶液会变蓝的是____(填“a”或“b”);C极上的电极反应式为___________________________。
(4)F极上的电极反应式为:_________________________________________________。
(5)当电路中通过0.02mol电子时,B电极上沉积0.64g金属X,则X为___(填元素符号),甲池中反应的化学方程式为______________________________________________________。
【答案】电解池 原电池 阴极 a 2Cl- -2e- =Cl2 ↑ 2H2O + 2e- =H2 ↑ + 2OH- Cu 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
【解析】
E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应,则E是金属铝,所以F是金属镁,乙是原电池,其中金属E电极Al电极是负极,所以D是阴极,C是阳极,B是阴极,A是阳极,F是金属镁电极,是正极,根据原电池和电解池的工作原理来书写电极反应即可。
(1)分析可知,乙是原电池,所以甲是电解池,故答案为:电解池;原电池;
(2)分析可知,D极为阴极,故答案为:阴极;
(3)D是阴极,该电极上会产生氢气,所以b中冒气泡,a中是氯离子失电子产生氯气,能将碘离子氧化为单质,遇到淀粉变蓝色,所以烧杯中溶液会变蓝的是a,C极为阳极,的电极反应式为2Cl--2e-=Cl2↑,故答案为:a;2Cl--2e-=Cl2↑;
(4)分析可知F是金属镁电极,是正极,电极反应式为:2H2O + 2e- =H2 ↑ + 2OH-,故答案为:2H2O + 2e- =H2 ↑ + 2OH-;
(5)设其摩尔质量为M,电解时,B电极上的电极反应式为:X2++2e-=X
X2++2e-=X
2mol 1mol
0.02mol ![]()
M=64g/mol,则X为Cu;甲池中反应的化学方程式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4;故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4;故答案为:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4。
2Cu+O2↑+2H2SO4。

【题目】碱式硫酸铁[Fe(OH)SO4]可用做净水剂、媒染剂等。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的部分工艺如下:
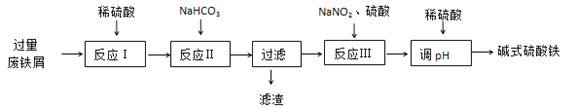
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)反应Ⅰ中氧化还原反应的离子方程式__________________ 、 ___________________。
(2)反应Ⅱ中加入NaHCO3调节体系的pH在_____________范围内。
(3)反应Ⅲ中生成的气体遇空气变红棕色,该反应的离子方程式是_____________________。
(4)若反应Ⅲ中通入O2可减少NaNO2的用量,当消耗1molO2可节约n(NaNO2)=_____mol。
(5)用稀硫酸调节体系的pH时,若硫酸加入量过少,容易生成沉淀;若硫酸加入量过大,不利于产品形成,用化学平衡移动原理说明其原因______________________________。
(6)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为____________________________
【题目】t℃时,在一个体积为2L密闭容器中加入反应物A、B,发生如下反应:A(s)+2B(g)![]() 3C(g)。反应过程中的部分数据如下表所示,下列说法正确的是
3C(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质 | 起始 | 2分钟 | 4分钟 | 6分钟 |
A | 2 mol | 1.2 mol | ||
B | 6 mol | 3.0 mol | ||
C | 0 mol | x mol | 4.5 mol |
A. 前2分钟内,A的反应速率为0.2molL-1min-1
B. 表中x的值为3.6
C. 4分钟时,反应达到平衡状态,此时正、逆反应的速率都为0
D. 升高温度,正、逆反应的速率都会增大