题目内容
9.X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大.下列说法不正确的是( )| A. | M与X的化合物对应的水化物不一定都是强酸 | |
| B. | Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同 | |
| C. | 气态氢化物的热稳定性:M<N | |
| D. | 离子半径r:r(X2-)>r(Y+) |
分析 X、Y、M、N是短周期主族元素,且原子序数依次增大,X原子的最外层电子数是电子层数的3倍,最外层电子数不超过8个,K层不超过2个,所以其电子层数为2,最外层电子数为6,则X是O元素;X、M同主族且都是短周期元素,所以M是S元素;N原子序数大于M且为短周期主族元素,所以N是Cl元素;Y原子在短周期主族元素中原子半径最大,则Y是Na元素.
解答 解:X、Y、M、N是短周期主族元素,且原子序数依次增大,X原子的最外层电子数是电子层数的3倍,最外层电子数不超过8个,K层不超过2个,所以其电子层数为2,最外层电子数为6,则X是O元素;X、M同主族且都是短周期元素,所以M是S元素;N原子序数大于M且为短周期主族元素,所以N是Cl元素;Y原子在短周期主族元素中原子半径最大,则Y是Na元素.
A.M是S元素、X是O元素,二者形成的化合物对应的水化物中,H2SO3是弱酸,H2SO4是强酸,故A正确;
B.Na2O中只含离子键、Na2O2中含有共价键和离子键,所以化学键类型不相同,阴、阳离子的个数比相同,故B错误;
C.元素非金属性越强,其气态氢化物的稳定性越强,非金属性N(Cl)>M(S),所以气态氢化物的热稳定性:M<N,故C正确;
D.电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径:r(O2-)>r(Na+),故D正确;
故选B.
点评 本题考查原子结构和元素周期律的关系,明确元素种类是解题关键,注意对元素化合物的掌握,题目难度不大,知道过氧化钠中存在的化学键.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
8.下列叙述正确的是( )
| A. | 稀盐酸可除去烧瓶内残留的MnO2 | B. | 可用磨口玻璃瓶保存NaOH溶液 | ||
| C. | 稀硝酸可除去试管内壁的银镜 | D. | 煮沸自来水可除去其中的Ca(HCO3)2 |
17.用如图实验装置进行相应实验,装置正确且能达到实验目的是( )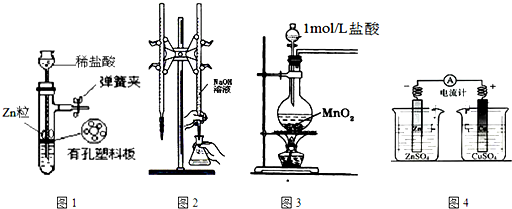

| A. | 用图1所示装置制取少量H2 | |
| B. | 用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度 | |
| C. | 用图3所示装置制取少量Cl2 | |
| D. | 用图4所示装置确定导线中有电流通过及并确定电流方向 |
4.下列转化及解释均正确的是( )
| 转化 | 解释 | |
| A | CuS+H2SO4=CuSO4+H2S↑ | 酸性:H2SO4>H2S |
| B | AgCl(s)+I-(aq)?AgI(s)+Cl-(aq) | Kap(AgCl)<Kap(AgI) |
| C | 2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;Fe+S$\frac{\underline{\;加热\;}}{\;}$FeS | 氧化性:Cl2>S |
| D | C(s,石墨)=C(s,金刚石)△H=+1.9kL/mol | 稳定性:石墨<金刚石 |
| A. | A | B. | B | C. | C | D. | D |
14.溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图甲装置制取(该反应放出热量).制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象.(如图乙)下列说法错误的是( )
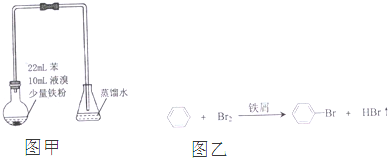

| A. | 制备溴苯的反应属于取代反应 | |
| B. | 白雾出现是因为HBr易挥发且极易溶于水 | |
| C. | 装置图中长直玻璃导管仅起导气作用 | |
| D. | 溴苯中溶有少量的溴,可用NaOH溶液洗去 |
1.化学与人类生产、生活,社会可持续发展密切相关,下列说法正确的是( )
| A. | 用厨房垃圾发酵制沼气属于物理变化 | |
| B. | 可用水作镁铝合金爆炸时的灭火剂 | |
| C. | 推广使用煤液化技术科减少温室气体二氧化碳的排放 | |
| D. | 超导材料K3C60在熔融状态下能够导电,说明K3C60是电解质 |
18.下列实验的叙述正确的是( )
| A. | 酸碱中和滴定需将标准溶液直接注入到用水清洗后的滴定管中 | |
| B. | 若需94 mL1.00mol/LNaCl溶液,需称5.85g NaCl配制成100mL溶液 | |
| C. | 用一元酸和一元碱测定中和反应热时,取等体积等浓度的稀溶液为佳 | |
| D. | 测定稀酸或稀碱溶液的pH时,需将待测液直接滴在湿润的pH试纸上 |
 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的沸点见附表).其实验步骤为:
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的沸点见附表).其实验步骤为: