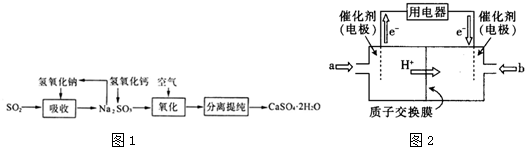
题目内容
18.下列实验的叙述正确的是( )| A. | 酸碱中和滴定需将标准溶液直接注入到用水清洗后的滴定管中 | |
| B. | 若需94 mL1.00mol/LNaCl溶液,需称5.85g NaCl配制成100mL溶液 | |
| C. | 用一元酸和一元碱测定中和反应热时,取等体积等浓度的稀溶液为佳 | |
| D. | 测定稀酸或稀碱溶液的pH时,需将待测液直接滴在湿润的pH试纸上 |
分析 A、在注入标准液之前,要先将滴定管润洗;
B、由于无94mL的容量瓶,故应选择100mL的容量瓶,配制出100mL溶液;
C、为了让物质充分反应,应让其中的一种过量;
D、测溶液的pH时,pH试纸不能润湿.
解答 解:A、在注入标准液之前,要先将滴定管润洗,如果没有润洗就注入,会引起标准液的稀释,则导致滴定结果有误差,故A错误;
B、由于无94mL的容量瓶,故应选择100mL的容量瓶,配制出100mL溶液,则所需的氯化钠的质量m=CVM=1mol/L×0.1L×58.5g/mol=5.85g,故B正确;
C、为了让物质充分反应,应让其中的一种过量,故应让其中一种物质的浓度稍高点,故C错误;
D、测溶液的pH时,pH试纸不能润湿,试纸润湿后会对待测液造成稀释,故D错误.
故选B.
点评 本题考查了酸碱中和滴定中滴定管的使用、配制一定物质的量浓度的溶液所需溶质的计算以及溶液pH的计算等问题,难度不大.

练习册系列答案
相关题目
17.短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料.下列叙述正确的是( )
| A. | 原子最外层电子数由多到少的顺序:Y、X、W、Z | |
| B. | 原子半径由大到小的顺序:W、Z、Y、X | |
| C. | 元素非金属性由强到弱的顺序:Z、W、X | |
| D. | 简单气态氢化物的稳定性由强到弱的顺序:X、Y、W |
9.X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大.下列说法不正确的是( )
| A. | M与X的化合物对应的水化物不一定都是强酸 | |
| B. | Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同 | |
| C. | 气态氢化物的热稳定性:M<N | |
| D. | 离子半径r:r(X2-)>r(Y+) |
6.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 17.6 g丙烷中所含的共价键数目为4NA | |
| B. | 常温下,1L pH=13的Ba(OH)2溶液中含有的OH-离子数目为0.2NA | |
| C. | 标准状况下,5.6 L NO和5.6 L O2混合后的分子总数目为0.5NA | |
| D. | 电解精炼铜时,若阳极质量减少64 g,则阴极得到电子的数目为2NA |
3.如图所示,将纯Fe棒和石墨棒插入1L 饱和NaCl溶液中.下列说法正确的是( )
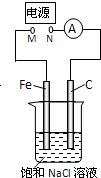

| A. | 去掉电源,将M、N用导线直接相连,则Fe棒上产生气泡 | |
| B. | M接电源负极,N接电源正极,Fe棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| C. | M接电源正极,N接电源负极,将石墨棒换成Cu棒,电解质溶液换成CuSO4溶液,则可实现在铁棒上镀铜 | |
| D. | 去掉电源,将M、N用导线直接相连,烧杯中的溶液换成经酸化的3% NaCl溶液,向Fe电极区滴入2滴K3[Fe(CN)6]溶液,反应一段时间后,烧杯中产生蓝色沉淀 |
10.某同学利用锌、氧化铜和稀硫酸制取铜,他设计了两套方案,
方案Ⅰ:利用锌与足量稀硫酸反应制氢气,氢气还原氧化铜;
方案Ⅱ:氧化铜溶于稀硫酸生成硫酸铜,然后用锌与硫酸铜反应制备铜.
下列关于方案Ⅰ和Ⅱ的评价不正确的是( )
方案Ⅰ:利用锌与足量稀硫酸反应制氢气,氢气还原氧化铜;
方案Ⅱ:氧化铜溶于稀硫酸生成硫酸铜,然后用锌与硫酸铜反应制备铜.
下列关于方案Ⅰ和Ⅱ的评价不正确的是( )
| A. | 方案Ⅱ比方案Ⅰ操作简便 | |
| B. | 等质量的锌,相同条件下方案Ⅰ和方案Ⅱ中制得的铜的质量相同 | |
| C. | 等质量的H2SO4参加反应,方案Ⅰ制取铜的质量比方案Ⅱ的少 | |
| D. | 为了加快锌与稀硫酸反应,可以在溶液中加入少量氧化铜 |