题目内容
14.溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图甲装置制取(该反应放出热量).制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象.(如图乙)下列说法错误的是( )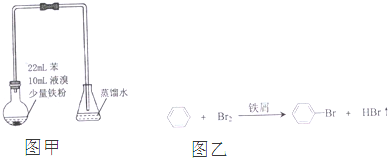
| A. | 制备溴苯的反应属于取代反应 | |
| B. | 白雾出现是因为HBr易挥发且极易溶于水 | |
| C. | 装置图中长直玻璃导管仅起导气作用 | |
| D. | 溴苯中溶有少量的溴,可用NaOH溶液洗去 |
分析 A、有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应;
B、HBr溶于水易形成白雾;
C、苯与溴水均容易挥发,据此解答即可;
D、溴与氢氧化钠反应生成溴化钠和次溴酸钠,据此解答即可.
解答 解:A、苯和液溴混合后撒入铁粉,在铁作催化剂条件下,苯环上的氢原子被溴原子取代生成溴苯,属于取代反应,故A正确;
B、HBr溶于水易形成白雾,故B正确;
C、苯和溴在铁的作用下反应剧烈,可以达到沸腾,使苯和溴成为蒸汽,在经过长导管时,可以将之冷凝并回流下来,故长导管的作用是导气和冷凝回流,故C错误;
D、溴苯与氢氧化钠不反应,溴与氢氧化钠反应生成溴化钠和次溴酸钠,可用NaOH溶液洗涤除去溴苯中的溴,故D正确,
故选C.
点评 本题主要考查的是溴苯的制取,涉及混合物的提纯、仪器的作用等,综合性较强,难度不大.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
2.关于下列装置的叙述正确的是( )
 |  |  |  |
| ① | ② | ③ | ④ |
| A. | 装置①可用于模拟氯碱工业生产氯气 | |
| B. | 装置②的原理可用于潮汐能发电站钢阀门的保护 | |
| C. | 装置③可用于食盐水的蒸发结晶 | |
| D. | 装置④可用于二氧化锰与浓盐酸反应制取氯气 |
9.X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大.下列说法不正确的是( )
| A. | M与X的化合物对应的水化物不一定都是强酸 | |
| B. | Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同 | |
| C. | 气态氢化物的热稳定性:M<N | |
| D. | 离子半径r:r(X2-)>r(Y+) |
6.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 17.6 g丙烷中所含的共价键数目为4NA | |
| B. | 常温下,1L pH=13的Ba(OH)2溶液中含有的OH-离子数目为0.2NA | |
| C. | 标准状况下,5.6 L NO和5.6 L O2混合后的分子总数目为0.5NA | |
| D. | 电解精炼铜时,若阳极质量减少64 g,则阴极得到电子的数目为2NA |
3.如图所示,将纯Fe棒和石墨棒插入1L 饱和NaCl溶液中.下列说法正确的是( )
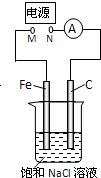

| A. | 去掉电源,将M、N用导线直接相连,则Fe棒上产生气泡 | |
| B. | M接电源负极,N接电源正极,Fe棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| C. | M接电源正极,N接电源负极,将石墨棒换成Cu棒,电解质溶液换成CuSO4溶液,则可实现在铁棒上镀铜 | |
| D. | 去掉电源,将M、N用导线直接相连,烧杯中的溶液换成经酸化的3% NaCl溶液,向Fe电极区滴入2滴K3[Fe(CN)6]溶液,反应一段时间后,烧杯中产生蓝色沉淀 |
4.下列叙述正确的是( )
| A. | 苯与溴水混合可发生加成反应 | |
| B. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 | |
| C. | 煤的干馏可以得到苯、甲苯和二甲苯 | |
| D. |  命名为2-甲基-3-戊烯 命名为2-甲基-3-戊烯 |



 X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子.
X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子.