题目内容
10.现有原子序数依次增大的A、B、C、D、E五种短周期元素.已知A、C、D三原子的最外电子层中共有10个电子,这三种元素的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水.请回答:(1)B元素在元素周期表中的位置是第三周期第ⅡA族,元素符号是Mg.
(2)D、E两元素的最高价氧化物的水化物中,酸性较强的是HClO4(填化学式).
(3)写出A的最高价氧化物的水化物所含有的化学键是离子键、共价键.
(4)A元素的原子与氧原子按1:1的个数比形成的化合物11.7g与足量二氧化碳完全反应,有0.15mol 电子发生转移.
分析 原子序数依次增大的A、B、C、D、E五种短周期元素,已知A、C、D三原子的最外电子层中共有10个电子,这三种元素的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水,则C为Al元素,A为Na、D为S元素,结合E为短周期元素及原子序数大于S,则E为Cl元素;B的原子序数大于Na、小于Al,则B为Mg元素,据此结合元素周期律知识进行解答.
解答 解:原子序数依次增大的A、B、C、D、E五种短周期元素,已知A、C、D三原子的最外电子层中共有10个电子,这三种元素的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水,则C为Al元素,A为Na、D为S元素,结合E为短周期元素及原子序数大于S,则E为Cl元素;B的原子序数大于Na、小于Al,则B为Mg元素,
(1)B为Mg元素,其原子序数为12,在元素周期表中位于第三周期第ⅡA族,元素符号为Mg,
故答案为:第三周期第ⅡA族;Mg;
(2)D、E两元素分别为S、Cl,非金属性越强,最高价氧化物的水化物的酸性越强,由于非金属性:Cl>S,酸性较强的为高氯酸,化学式为:HClO4,
故答案为:HClO4;
(3)A的最高价氧化物的水化物为NaOH,氢氧化钠所含有的化学键为离子键和共价键,
故答案为:离子键、共价键;
(4)A元素的原子与氧原子按1:1的个数比形成的化合物为Na2O2,与二氧化碳反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,11.7gNa2O2的物质的量为:$\frac{11.7g}{78g/mol}$=0.15mol,反应中过氧化钠其氧化剂、还原剂作用,各占一半,故转移电子的物质的量为:0.15mol×$\frac{1}{2}$×2×[0-(-1)]=0.15mol,
故答案为:0.15.
点评 本题考查结构性质位置关系应用,题目难度中等,推断元素是解题的关键,注意对元素化合物知识的掌握,试题培养了学生的分析能力及灵活应用基础知识的能力.

| A. | OCS中含有1个σ键和1个π键 | |
| B. | OCS高温分解时,碳元素化合价升高 | |
| C. | OCS、C02、CO、S晶体类型相同 | |
| D. | 22.4LOCS中约含有3×6.02×1023个原子 |
| A. | 明矾常作净水剂 | |
| B. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| C. | 在水果贮藏室中,放几块被KMnO4溶液浸透过的“砖块”,可延长水果保存时间 | |
| D. | 汽车尾气中的CO、NO等都是汽油和柴油的不完全燃烧产物 |
| A. | O2和O3 | B. | H2O和H2O2 | ||
| C. | CH4和CH3CH3 | D. | 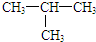 和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |

| A. | Y的原子半径在同周期主族元素中最大 | |
| B. | W的非金属性比Z的弱 | |
| C. | Z的气态氢化物的稳定性在同主族元素中最强 | |
| D. | W的最高价氧化物对应的水化物是强酸 |
| A. | 将两颗假牙都做成黄金的 | B. | 将两颗假牙都做成不锈钢的 | ||
| C. | 将金假牙改为铝质假牙 | D. | 将两颗假牙都做成特殊树脂的 |
| A. | 只要使用合理的催化剂及载体,就可完全清除NO和CO | |
| B. | 使用催化剂只能改变反应的速率不能改变反应的平衡常数 | |
| C. | 假设该反应在密闭容器中进行,一段时间后达到平衡时c(NO)=c(CO) | |
| D. | 恒容条件下,通入惰性气体可提高NO转化率 |
| A. | Q=92 kJ | B. | Q<92 kJ | C. | Q>92 kJ | D. | Q=194kJ |
| A. | 20.5% | B. | 18.6% | C. | 17.6% | D. | 无法计算 |