题目内容
【题目】雾霾天气肆虐给人类健康带来了严重影响。燃煤和汽车尾气 是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2C02(g)+N2 (g) △H <0 。
2C02(g)+N2 (g) △H <0 。
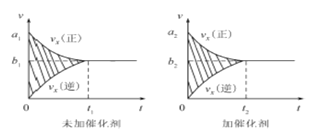
①该反应的速率时间图像如右图中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其速率时间图像如右图中右图所示。以下说法正确的是 (填对应字母)。
A.a1>a2 B.b1 <b2 C.t1>t2
D.右图中阴影部分面积更大 E.左图中阴影部分面积更大
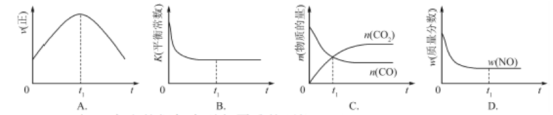
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。已知:CH4(g)+2N02(g) = N2(g)+C02(g)+2H20(g) △H=-867 kJ/mol
2N02(g)= N204(g) △H= - 56.9 kJ/mol H20(g) = H20(l) △H = - 44.0 kJ/mol
写出CH4催化还原N204 (g)生成N2和H20(1)的热化学方程式: 。
(3)CH4和H20(g)在催化剂表面发生反应CH4 + H20 = C0 + 3H2 ,该反应在不同温度下的化学平衡常数如下表:
①该反应是 反应(填“吸热”或“放热 ”)。
②T℃时,向1L密闭容器中投入1mol CH4 和1mol H20(g),平衡时C(CH4)=0.5 mol·L-1 , 该温度下反应CH4 + H20 = CO+3H2的平衡常数K= 。
(4)甲烷燃料电池可以提升能量利用率。如图是利用甲烷燃料电池电解100mL lmol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24 L(设电解后溶液体积不变)。
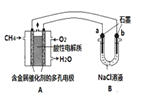
①甲烷燃料电池的负极反应式: 。
②电解后溶液的pH = , (忽略氯气与氢氧化钠溶液反应)。
③阳极产生气体的体积在标准状况下是 L。
【答案】(1)①BC②BD
(2)CH4(g)+2N204(g)=N2(g)+2H20(l)+C02(g) △H=-898kJ/mol
(3)①吸热②6.75
(4)①CH4-8e一+2H20=C02+8H+②14③1.68
【解析】
试题分析:(1)①对可逆反应2NO(g)+2CO(g)![]() 2C02(g)+N2 (g) △H <0的v-t图象,如若其它条件不变,只是在反应前加入合适的催化剂,a1、a2为两种条件下正反应速率,催化剂加快反应速率,则a1<a2,A项错误;使用催化剂缩小达到化学平衡的时间,则加催化剂时达到平衡的反应速率大,所以b1<b2,B项正确;使用催化剂缩小达到化学平衡的时间,则t1>t2,C项正确;阴影部分的面积为反应物浓度的变化量,平衡状态没有改变,则阴影部分面积相同,D、E项错误;答案选BC。
2C02(g)+N2 (g) △H <0的v-t图象,如若其它条件不变,只是在反应前加入合适的催化剂,a1、a2为两种条件下正反应速率,催化剂加快反应速率,则a1<a2,A项错误;使用催化剂缩小达到化学平衡的时间,则加催化剂时达到平衡的反应速率大,所以b1<b2,B项正确;使用催化剂缩小达到化学平衡的时间,则t1>t2,C项正确;阴影部分的面积为反应物浓度的变化量,平衡状态没有改变,则阴影部分面积相同,D、E项错误;答案选BC。
②A.到达平衡后正、逆反应速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,反应未到达平衡,A项错误;B.该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,B项正确;C.t1时刻后二氧化碳、CO的物质的量发生变化,t1时刻未到达平衡状态,C项错误;D.NO的质量分数为定值,t1时刻处于平衡状态,D项正确;答案选BD。
(2)已知:CH4(g)+2N02(g)=N2(g)+C02(g)+2H20(g) △H=-867kJ/mol①、2N02(g)=N204(g)△H=-56.9kJ/mol②、H20(g)=H20(l) △H=-44.0kJ/mol③,根据盖斯定律,①-②+④×2可得CH4(g)+2N204(g)=N2(g)+2H20(l)+C02(g),所以△H=-867kJ/mol-(-56.9kJ/mol)+2(-44.0)kJ/mol=-898kJ/mol,CH4(g)+2N204(g)=N2(g)+2H20(l)+C02(g)△H=-898kJ/mol。
(3)①根据表格提供的信息,温度升高,K值增大,说明平衡正向移动,则该反应是吸热反应。
②T℃时,向1L密闭容器中投入1molCH4和1molH20(g),平衡时C(CH4)=0.5mol·L-1,根据化学反应方程式可知,平衡时H2O的浓度为0.5mol/L,CO的浓度为0.5mol/L,氢气的浓度为1.5mol/L,该温度下反应CH4+H20=CO+3H2的平衡常数K=([CO]×[H2]3)÷([CH4]×[H2O])=(0.5×1.5×1.5×1.5)÷(0.5×0.5)=6.75
(4)①原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+,负极电极反应式为CH4-8e一+2H20=C02+8H+;
②由方程式:2NaCl+2H2O![]() 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
2 2 22.4
0.1L×1mol/L 0.1 1.12L
由题可知:Cl-放电之后反应为电解水,c(OH-)=0.1mol÷0.1L=1mol/L,c(H+)=1×10-14÷1= 10-14mol/L,所以pH=14。
③阴极的电极反应为2H++2e-=H2↑,标准状况下2.24 L氢气的物质的量为0.1mol,阴极放电0.02mol,阳极的电极反应式2Cl--2e-=Cl2↑、4OH--4e-=2H2O+O2↑,NaCl的物质的量为0.1mol,则产生氯气0.05mol,放电0.1mol,OH-放电0.1mol,生成氧气0.1mol÷4= 0.025mol,产生气体总物质的量为0.075mol,混合气体在标准状况下的体积为0.075mol ×22.4L/mol=1.68L。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案