题目内容
【题目】综合利用海水资源是一个重要的研究课题,下面是工业上用海水制备食盐、纯碱、金属镁等物质的一种流程:

完成下列填空
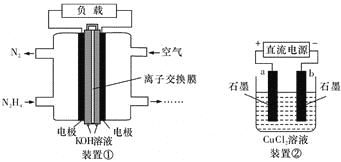
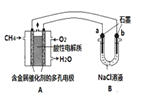
(1)气体Y是 (填化学式),溶液II中发生反应的化学方程式是: 。实验室可用右图装置模拟此制备过程,仪器c的名称 ,反应时a管应通入 。

(2)为了测定碳酸氢钠中杂质氯元素的含量,先称取a g试样用蒸馏水溶解,再用足量稀硝酸酸化,配成100 mL溶液,取出20 mL注入锥形瓶中,然后用c mol/LAgNO3标准溶液滴定Cl-,K2CrO4溶液为指示剂。已知:常温下Ksp(AgCl)=2×10-10 ,Ksp(Ag2CrO4)=1.12×10-12 ,Ag2CrO4为砖红色。
①当Cl-恰好沉淀完全即溶液中残余c(Cl-)=1.0×10-5 mol·L-1,则此时溶液中的c(CrO42-)= mol·L-1。
②滴定过程中,使用棕色滴定管的原因是 ;当观察到出现 时停止滴定,若此时消耗了AgNO3标准溶液v mL,则碳酸氢钠样品中杂质氯元素的质量分数表达式为 。
③下列情况会造成实验测定结果偏低的是 。
a.盛放AgNO3溶液的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
【答案】(1)CO2 NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl 干燥管 NH3
(2)①2.8×10-3②防止硝酸银见光分解;砖红色沉淀且在半分钟内不再消失;![]() ③ c
③ c
【解析】
试题分析:(1)由于氨气极易溶于水而二氧化碳微溶于水,为得到大量的碳酸氢钠,应先通入氨气,再通入二氧化碳,所以Y为二氧化碳;根据流程图可知,反应物为氯化钠、氨气、二氧化碳和水,生成物为碳酸氢钠和氯化铵,溶液II中发生反应的化学方程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;仪器c的名称为干燥管,由于氨气极易溶于水,二氧化碳在水中的溶解度不大,a管通入氨气,一方面可防止倒吸,另一方面有利于碳酸氢钠的生成。
(2)①由氯化银与铬酸银的溶度积可知,氯化银的溶解度小于铬酸银,所以当Cl-恰好沉淀完全时,铬酸银正好开始沉淀,则溶液中银离子浓度为2×10-10mol/L÷1×10-5mol/L=2×10-5mol/L,此时溶液中的c(CrO42-)=(1.12×10-12)÷(2×10-5)2=2.8×10-3mol·L-1。
②由于硝酸银见光分解,使用棕色滴定管的原因是防止硝酸银见光分解;当Cl-恰好沉淀完全时,铬酸银正好开始沉淀,停止滴定,所以当观察到出现砖红色沉淀且在半分钟内不再消失时停止滴定;根据题给信息,滴定时发生的反应为Cl-+Ag+=AgCl↓,消耗了AgNO3标准溶液v mL时,n(AgNO3)=c×v ×10-3mol,则碳酸氢钠样品中杂质氯元素的质量分数表达式为![]() 。
。
③ a.盛放AgNO3溶液的滴定管水洗后未用标准液润洗,硝酸银的浓度减小,滴定时所需硝酸银的体积增大,会造成实验测定结果偏高,a错误;b滴定管滴定前尖嘴部分有气泡,滴定后消失,使读出的硝酸银的体积增大,造成实验测定结果偏高,b错误;c.滴定前仰视读数,滴定后俯视读数,使读出的硝酸银的体积减小,造成实验测定结果偏低,c正确;答案选c。

【题目】下表为元素周期表的一部分用元素符号或化学式回答下列问题。
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ① | ⑦ | ④ | ||||
3 | ③ | ⑤ | ⑧ | ⑩ | ||||
4 | ② | ⑨ |
(1)写出⑥与⑧元素组成的分子的电子式:_______。
(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为 , 第三周期中除⑩元素以外离子半径最小的是 (填离子符号)。
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是 (填化学式),元素⑦的氢化物的结构式为 ; 该氢化物和元素④单质反应的化学方程式为 。
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为 。在反应后的溶液中加入有机溶剂苯,震荡后静置的实验现象为 。
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式 ;④⑧⑨元素的离子的还原性由强到弱顺序为 (用离子符号)。