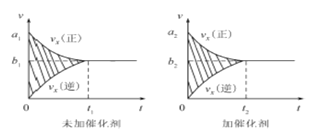
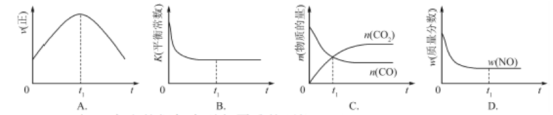
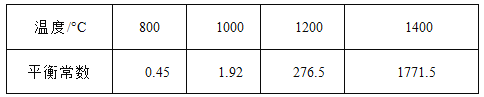
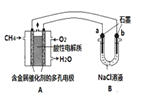
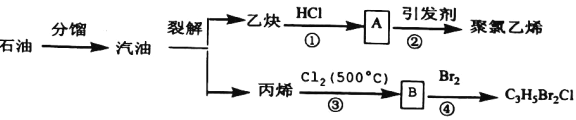
题目内容
【题目】现有短周期元素X形成的单质A与NaOH溶液反应,有如下转化关系![]() ,(若产物中有水生成则省略未表示出来)。
,(若产物中有水生成则省略未表示出来)。
(1)若常温常压下,A为气态,且B、C中均有X元素,则A与NaOH溶液反应的离子方程式为 ;
(2)若常温常压下,A为非金属固态单质,且其在电子工业中有着重要的用途,则工业制取A化学方程式为 ;
(3)若A为金属,C为气体,则A 与NaOH溶液反应的离子方程式为
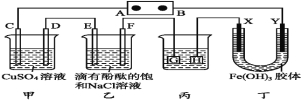
(4)由(2)和(3)中两种单质形成合金在工业、建筑业中有重要的用途。一个探究性学习小组,他们拟
用该合金与足量稀硫酸的反应测定通常状况下气体摩尔体积,实验装置如下:
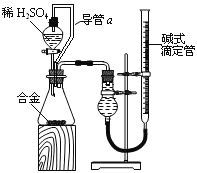
①装置中导管a的作用是平衡分液漏斗上下管口的压强,有利于液体滴下和 ;
②实验中准确测得4个数据:实验前该合金的质量m1g,实验后残留固体的质量m2g,实验前后碱式滴定管中液面读数分别为V1mL、V2mL;则通常状况时气体摩尔体积Vm=_____L·moL-1。
【答案】(1)Cl2+2OH—=Cl—+ClO—+H2O (2)2C+SiO2![]() 2CO↑+Si
2CO↑+Si
(3)2Al+2OH—+6H2O=2【Al(OH)4】—+3H2↑
(4)①使测得的气体体积较准确,减少实验误差②18(V1-V2)10-3/(m1-m2)
【解析】
试题分析:(1)若常温常压下,A为气态,且B、C中均有X元素,则A是氯气,氯气与NaOH溶液反应的离子方程式为Cl2+2OH—=Cl—+ClO—+H2O;
(2)若常温常压下,A为非金属固态单质,且其在电子工业中有着重要的用途,则A是硅,工业制取单质硅的化学方程式为2C+SiO2![]() 2CO↑+Si;
2CO↑+Si;
(3)若A为金属,C为气体,则A是铝,铝与NaOH溶液反应的离子方程式为2Al+2OH—+6H2O=2【Al(OH)4】—+3H2↑。
(4)①由于有氢气产生,则装置中导管a的另一个作用是使测得的气体体积较准确,减少实验误差;
②合金中硅与稀硫酸不反应,铝能与稀硫酸反应,因此参加反应的铝是(m1—m2)g。实验前后碱式滴定管中液面读数分别为V1mL、V2mL,则产生的氢气是V1mL—V2mL,所以根据2Al~3H2可知![]() ,因此通常状况时气体摩尔体积Vm=
,因此通常状况时气体摩尔体积Vm=![]() L·moL-1。
L·moL-1。

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案