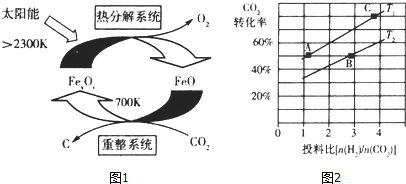
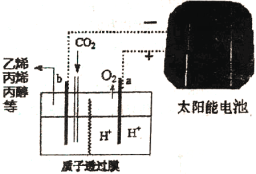
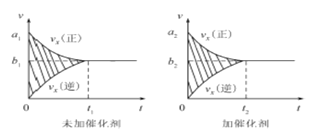
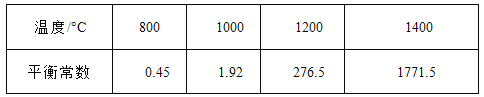
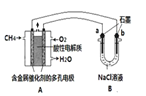
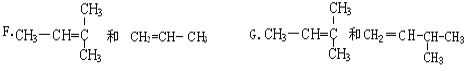��Ŀ����
����Ŀ��ԭ�Ӻ�������Ų�ʱ��������K��L��M����ʾ��һ�㡢�ڶ��㡢�����㣻AԪ��ԭ��M���Ӳ�����3�����ӣ�BԪ����AԪ�ص�ԭ�Ӻ�����Ӳ�����ͬ��BԪ�ص�ԭ������������Ϊ1��CԪ�ص�ԭ�ӱ�BԪ��ԭ����4�����ӡ�
��1��BԪ�ص�ԭ�ӽṹʾ��ͼΪ ��
��2��AԪ�������ڱ��е�λ�� ��
��3������BԪ�صĻ���������ɫ����������ʱ����� ɫ��
��4��A��B������������ˮ�������Ӧ�����ӷ���ʽΪ�� ��
��5��CԪ�ص��������ж��֣�������ɫΪ����ɫ�������������������ѧʽ��
��6��A��B��ȣ�A�Ľ�������������B�Ľ����ԣ�����ǿ����������������
��7��A�ĵ���������������������NaOH��Һ��Ӧ����������������������
���𰸡�(1)![]() (2) �������� ����A��(3)��ɫ(4) Al(OH)3+OH-= AlO2-+ 2H20
(2) �������� ����A��(3)��ɫ(4) Al(OH)3+OH-= AlO2-+ 2H20
(5) NO2(6) ��(7) ��
�����������������AԪ��ԭ��M���Ӳ�����3�����ӣ�����A��AlԪ�أ�BԪ����AԪ�ص�ԭ�Ӻ�����Ӳ�����ͬ��BԪ�ص�ԭ������������Ϊ1��B��NaԪ�أ�CԪ�ص�ԭ�ӱ�BԪ��ԭ����4������,C��NԪ�� ��
��1��NaԪ�ص�ԭ�ӽṹʾ��ͼΪ![]() ��
��
��2��AlԪ�������ڱ��е�λ�õ������� ����A�壻
��3��NaԪ�صĻ���ʻ�ɫ��
��4�����������������������Ӧ�����ӷ���ʽΪ��Al(OH)3+OH-= AlO2-+ 2H20��
��5��NԪ�ص���������ɫΪ����ɫ����NO2
��6��ͬ���ڴ����ҽ����Լ�����Al��Na��ȣ�Al�Ľ���������Na�Ľ�����
��7��Al ��NaOH��Һ��Ӧ�ܷ�Ӧ����ƫ�����ƺ�������

 ��������ϵ�д�
��������ϵ�д� ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�����Ŀ���±�ΪԪ�����ڱ���һ������Ԫ�ط��Ż�ѧʽ�ش��������⡣
���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | ||||
4 | �� | �� |
��1��д��������Ԫ����ɵķ��ӵĵ���ʽ��_______��
��2��������̬�⻯���������������ˮ���ﷴӦ�ķ���ʽΪ , ���������г���Ԫ���������Ӱ뾶��С���� �������ӷ��ţ���
��3���ڢۢ�����Ԫ������������Ӧ��ˮ���������ǿ���� (�ѧʽ)��Ԫ�������⻯��ĽṹʽΪ �� ���⻯���Ԫ�������ʷ�Ӧ�Ļ�ѧ����ʽΪ ��
��4��Ԫ�����ĵ������ڢ��γɵĻ��������Һ��Ӧ�����ӷ���ʽΪ ���ڷ�Ӧ�����Һ�м����л��ܼ��������õ�ʵ������Ϊ ��
��5������ͬ���壬�������ڵ�Ԫ�ص��������ĵ�����ȼ�����ɵĻ�����ĵ���ʽ ���ܢ��Ԫ�ص����ӵĻ�ԭ����ǿ����˳��Ϊ �������ӷ��ţ���