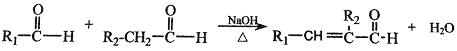题目内容
【题目】[化学——选修5:有机化学基础]
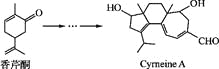
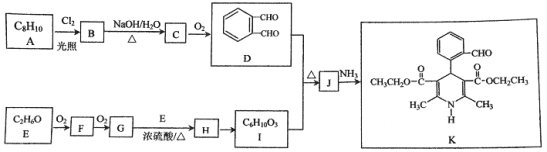
我国著名药学家屠呦呦因发现治疗疟疾新型药物青蒿素和双氢青蒿素而获2015年诺贝尔生理学或医学奖,震惊世界,感动中国。已知青蒿素的一种化学部分工艺流程如下:
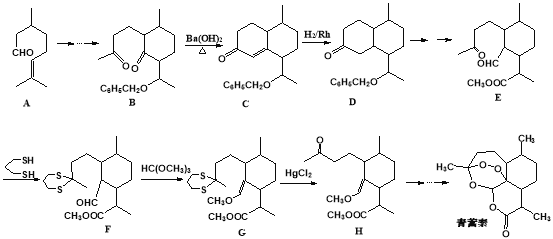
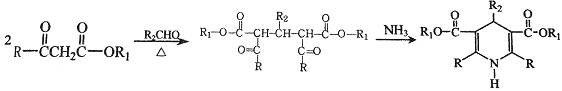
已知: 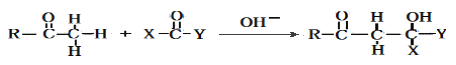
(1)下列有关说法中正确的是______________
A.青蒿素遇湿润的淀粉碘化钾试纸立刻显蓝色,是因为分子结构中含有酯基
B.青蒿素易溶于水,难溶于乙醇、苯等
C.青蒿素属于环状化合物,但不属于芳香族化合物
D.一定条件下,青蒿素能与氢氧化钠溶液反应
(2)化合物A中含有的非含氧官能团的名称是________________________,请选择下列合适的试剂来检验该官能团,试剂加入的正确顺序为_______________。
A.溴水 B.稀盐酸 C.新制氢氧化铜悬浊液 D.氢氧化钠溶液
(3)该工艺流程中设计E→F、G→H的目的是________________________ 。
(4)反应B→C,实际上可看作两步进行。试根据已知信息写出依次发生反应的反应类型是_______________、________________。
(5)M与A互为同系物,但比A少两个碳原子。满足下列条件的M的同分异构体有___种(不考虑立体异构)。① 含有六元环 ②能发生银镜反应
(6)请结合所学知识和上述信息,写出由苯甲醛和氯乙烷为原料(无机试剂任用),制备苄基乙醛(![]() )的路线流程图。路线流程图示例如下:
)的路线流程图。路线流程图示例如下:
![]()
【答案】(1)C D(2)碳碳双键 ; C B A (3)保护羰基 (4)加成反应 消去反应 (5)5
(6)![]()
【解析】
试题分析:(1)A.青蒿素中含有过氧键,具有强氧化性,可氧化碘化钾生成碘,使淀粉变蓝,A项错误;B.青蒿素含有酯基、醚键,所以青蒿素难溶于水,易溶于乙醇、苯等,B项错误;C.青蒿素含有环状结构,属于环状化合物,但没有苯环,不属于芳香族化合物,C项正确;D.青蒿素含有酯基,则在一定条件下,青蒿素能与氢氧化钠溶液反应,D项正确;答案选CD。
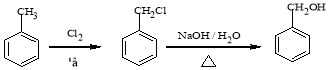
(2)根据A的结构简式可知,化合物A中含有的非含氧官能团的名称是碳碳双键,A中含有的官能团有醛基和碳碳双键,要检验碳碳双键,用溴水,但是溴水也能氧化醛基,所以先加入新制的氢氧化铜悬浊液,将醛基氧化成羧基,由于溴水和碱反应,所以再加入稀盐酸酸化,最后加入溴水检验碳碳双键,则试剂加入的正确顺序为C、B、A。
(3)由E→F的结构可知,羰基中C=O双键变成C-S单键,由G→H的结构可知C-S单键又变成羰基,所以该工艺流程中设计E→F、G→H的目的是保护羰基。
(4)由题目信息可知,结合B、C的结构可知,C=O双键变成C=C双键,应是B中连接羰基的甲基上的α-H与C=O先发生发生加成反应产生C-OH,再发生消去反应生成产生C=C双键生成C,所以依次发生反应的反应类型是加成反应、消去反应。
(5)A为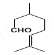 ,M与A互为同系物,但比A少两个碳原子,则M含有8个碳原子,有碳碳双键和醛基两种官能团,分子式为C8H14O,与M互为同分异构体,① 含有六元环,②能发生银镜反应,说明含有醛基,则符合条件的有
,M与A互为同系物,但比A少两个碳原子,则M含有8个碳原子,有碳碳双键和醛基两种官能团,分子式为C8H14O,与M互为同分异构体,① 含有六元环,②能发生银镜反应,说明含有醛基,则符合条件的有![]() ,甲基接到环的1、2、3、4号碳上,一个有4种,还有一种是
,甲基接到环的1、2、3、4号碳上,一个有4种,还有一种是![]() ,共5种。
,共5种。
(6)结合流程图中B→C→D的变化分析设计,氯乙烷在氢氧化钠水溶液、加热条件下生成乙醇,乙醇催化氧化生成乙醛,乙醛与苯甲醛在氢氧化钡条件下生成![]() ,在氢气/Rh条件下发生加成反应生成
,在氢气/Rh条件下发生加成反应生成![]() ,工艺流程图为:
,工艺流程图为:
![]() 。
。