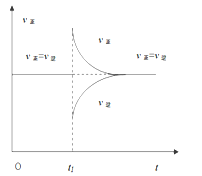
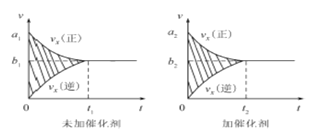
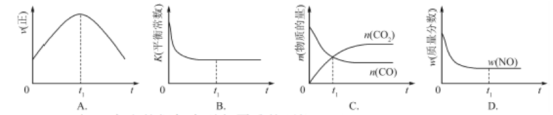
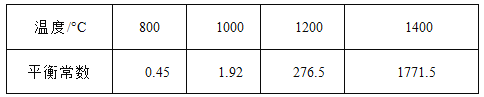
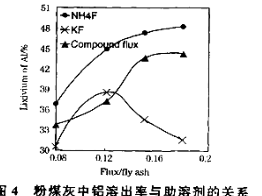
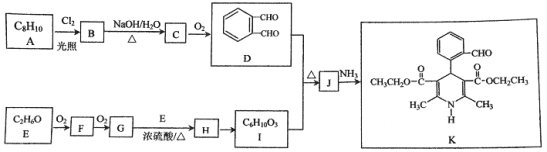
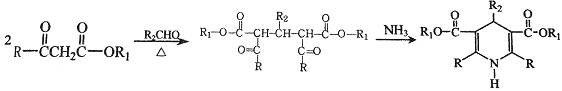
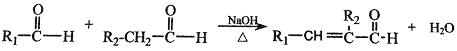题目内容
【题目】有机物A可以通过不同的反应得到B和C:
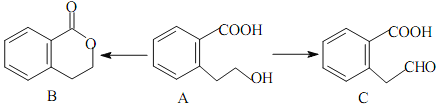
(1)A的分子式为_________________,C的含氧官能团名称为_________________。
(2)A制取C的有机反应类型为_________________;A制取B的化学方程式为:_________________。
(3)A发生消去反应后产物的结构简式为_________________,A分子中一定共面的碳原子有_________________个。
【答案】(1)C9H10O3;羧基、醛基
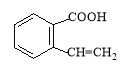 (2)氧化反应;
(2)氧化反应;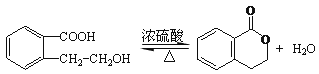 (3)
(3)![]() ;8个
;8个
【解析】
试题分析:(1)由结构简式可知A的分子式为C9H10O3,C中含羧基、醛基,故答案为:C9H10O3;羧基、醛基;
(2)A制取C为醇的催化氧化反应,该反应的化学方程式为![]() ,A制取B发生分子内酯化反应,反应类型为取代反应(或酯化反应),反应的方程式为
,A制取B发生分子内酯化反应,反应类型为取代反应(或酯化反应),反应的方程式为 ,故答案为:氧化反应;
,故答案为:氧化反应; ;
;
(3)A中含-OH,发生消去反应生成碳碳双键,则消去产物的结构简式为![]() ,A中苯环为平面结构,与苯环直接相连的C一定在同一平面内,则苯环中6个C与直接相连侧链上的2个C一定共面,即共8个C原子一定共面,故答案为:
,A中苯环为平面结构,与苯环直接相连的C一定在同一平面内,则苯环中6个C与直接相连侧链上的2个C一定共面,即共8个C原子一定共面,故答案为:![]() ;8。
;8。

【题目】下表为元素周期表的一部分用元素符号或化学式回答下列问题。
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ① | ⑦ | ④ | ||||
3 | ③ | ⑤ | ⑧ | ⑩ | ||||
4 | ② | ⑨ |
(1)写出⑥与⑧元素组成的分子的电子式:_______。
(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为 , 第三周期中除⑩元素以外离子半径最小的是 (填离子符号)。
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是 (填化学式),元素⑦的氢化物的结构式为 ; 该氢化物和元素④单质反应的化学方程式为 。
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为 。在反应后的溶液中加入有机溶剂苯,震荡后静置的实验现象为 。
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式 ;④⑧⑨元素的离子的还原性由强到弱顺序为 (用离子符号)。