题目内容
14.下列说法或表示方法中正确的是( )| A. | 等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多 | |
| B. | 氢气的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l);△H=-285.8 kJ•mol-1 | |
| C. | 已知中和热为57.3 kJ•mol-1,若将含0.5mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量要大于57.3 kJ | |
| D. | Ba(OH)2•8H2O(s)+2NH4Cl(s)═BaCl2(s)+2NH3(g)+10H2O(l);△H<0 |
分析 A、硫蒸气变化为硫固体为放热过程;
B、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
C、浓硫酸溶于水放热;
D、Ba(OH)2•8H2O(s)与NH4Cl(s)反应属于吸热反应.
解答 解:A、硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,故A错误;
B、在101kpa时,2gH2完全燃烧,生成液态水,放出285.8KJ热量,则氢气燃烧的热化学方程式表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8KJ/mol,故B错误;
C、中和热是强酸强碱的稀溶液反应生成1mol水时放出的热量,浓硫酸溶于水放热,将含1molNaOH的溶液和含0.5molH2SO4的浓硫酸混合,放出的热量大于57.3 kJ,故C正确;
D、Ba(OH)2•8H2O(s)与NH4Cl(s)反应属于吸热反应,则Ba(OH)2•8H2O(s)+2NH4Cl(s)═BaCl2(s)+2NH3(g)+10H2O(l)△H>0,故D错误;
故选C.
点评 本题考查了反应热量变化,热化学方程式的正误判断,物质状态与物质能量的关系等,题目难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
4.下列有关物质结构的表述正确的是( )
| A. | 乙酸的比例模型: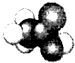 | B. | CO2的电子式: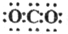 | ||
| C. | 乙醛结构简式:CH3COH | D. | 氯原子的结构示意图: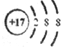 |
2.国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如右图,下列关于该物质的说法正确的是( )

| A. | 其分子式为C15H18O4 | |
| B. | 分子中含有2个手性碳原子 | |
| C. | 既能发生加聚反应,又能发生缩聚反应 | |
| D. | 既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色 |
9.下列物质的水溶液中,除水分子外,不存在其他分子的是( )
| A. | KHS | B. | HNO3 | C. | NaF | D. | H3PO4 |
19.下列各组离子在水中一定能大量共存,并形成无色透明溶液的是( )
| A. | Fe2+、OH-、SO42- | B. | H+、Na+、HCO3- | C. | NH4+、H+、NO3- | D. | K+、H+、MnO4- |
6.下列有关物质的性质与应用均正确的是( )
| A. | SO2和Cl2都能使品红溶液褪色,两者等体积混合可以增强漂白能力 | |
| B. | Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒 | |
| C. | MgO、Al2O3的熔点很高,二者都可用于制作耐高温材料 | |
| D. | 氨气是一种碱性气体,可用碱石灰或无水CaCl2干燥 |
14.有机物M的结构简式如图所示,下列说法中正确的是( )


| A. | M最多可与6molH2发生加成反应 | |
| B. | M中所有碳原子均可能在同一平面 | |
| C. | 1molM常温下最多可以与3molNaOH反应 | |
| D. | M可以发生加成、取代、消去等反应 |