题目内容
1.用惰性电极电解一定量的硫酸铜溶液,电解一段时间后,向电解液加入0.1mol碱式碳酸铜晶体(不含结晶水),恰好使溶液恢复到电解前的浓度和pH.下列有关叙述不正确的是( )| A. | 电解过程产生的气体体积(在标准状况下)为5.6 L | |
| B. | 电解过程只发生了2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4 | |
| C. | 电解过程转移的电子数为3.612×1023个 | |
| D. | 加入的碱式碳酸铜的反应是:Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O |
分析 电解硫酸铜溶液后溶液呈酸性,向电解后的溶液中加入碱式碳酸铜能恢复原溶液,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,溶液质量增加的量是铜、氢氧根离子,所以实际上电解硫酸铜溶液分两个阶段:
第一阶段2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu↓+O2↑+2H2SO4,
第二阶段:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,
将碱式碳酸铜化学式改变为2CuO•H2O•CO2,所以加入0.1molCu2(OH)2CO3 就相当于加入0.2molCuO和0.1mol水,根据氧化铜和水的量计算即可.
解答 解:电解硫酸铜溶液后溶液呈酸性,向电解后的溶液中加入碱式碳酸铜能恢复原溶液,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,溶液质量增加的量是铜、氢氧根离子,所以实际上电解硫酸铜溶液分两个阶段:
第一阶段2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu↓+O2↑+2H2SO4,
第二阶段:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,
将碱式碳酸铜化学式改变为2CuO•H2O•CO2,所以加入0.1molCu2(OH)2CO3 就相当于加入0.2molCuO和0.1mol水,
第一阶段:根据铜原子守恒知,电解硫酸铜溶液析出n(Cu)=n(CuO)=0.2mol,转移电子的物质的量=0.2mol×2=0.4mol;
第二阶段:电解生成0.1mol水转移电子的物质的量=0.1mol×2=0.2mol,
所以解过程中共转移的电子数为0.4mol+0.2mol=0.6mol;
A、电解分为两步电解硫酸铜和水生成氧气0.1mol,电解0.1mol水生成0.1mol氢气和0.05mol氧气,共生成气体0.15mol+0.1mol=0.25mol,气体标准状况体积=0.25mol×22.4L/mol=5.6L,故A正确;
B、电解硫酸铜溶液分两个阶段:第一阶段2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu↓+O2↑+2H2SO4,第二阶段:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,故B错误;
C、上述分析计算可知电子转移总数为0.6mol,电解过程转移的电子数=0.6mol×6.02×1023=3.612×1023个,故C正确;
D、加入的碱式碳酸铜的反应是:Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O,故D正确;
故选B.
点评 本题考查了电解原理,明确实际上加入的物质是解本题关键,再根据原子守恒、转移电子守恒来分析解答,难度中等.

| A. | W的最高价氧化物和SiO2都是两性氧化物 | |
| B. | 只含X、Y、Z三种元素的某水溶液一定呈酸性 | |
| C. | 由X、M与Z形成的化合物X2Z2和M2Z2中所含的化学键类型相同 | |
| D. | M的单质可用于从钛、锆等金属的氯化物中制备钛、锆等单质 |

| A. | 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol | |
| B. | 步骤Ⅱ中质量减少的固体物质一定是Fe2O3 | |
| C. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| D. | 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50% |
| 选项 | 实验目的 | 仪器 |
| A | 用溴水和CCl4除去NaBr溶液中少量NaI | 烧杯、玻璃棒、胶头滴管、分液漏斗 |
| B | 配制100mL l.0mol•L-1的NaOH溶液 | 药匙、天平、量筒、烧杯、玻璃棒、胶头滴管、100mL的容量瓶 |
| C | 从食盐水中获得NaCl晶体 | 酒精灯、玻璃棒、坩埚、泥三角 |
| D | 用盐酸除去BaSO4中混有的少量BaCO3 | 漏斗,烧杯、玻璃棒、胶头滴管、滤纸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 为减小酸碱中和滴定的实验误差,锥形瓶必须洗净、烘干后使用 | |
| B. | 在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 | |
| C. | 已知NaAlO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为NaAlO2 | |
| D. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,可知100 mL 0.1 mol•L-1 的盐酸与100 mL 0.1 mol•L-1 的氨水混合,放出的热量等于0.573 kJ |
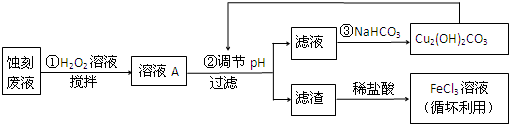
请回答:
(1)FeCl3-HCl溶液蚀刻铜板后的废液中含有的金属阳离子是Fe3+、Fe2+和Cu2+.
(2)FeCl3蚀刻液中加入盐酸的目的:可以抑制氯化铁水解,又可提高蚀刻速率.
(3)步骤①中加入H2O2溶液的目的是因为将Fe2+氧化成Fe3+,方便后续沉淀时除去.
(4)已知:
生成氢氧化物沉淀的pH
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
(5)写出步骤②中生成CO2的一个离子方程式4H++Cu2(OH)2CO3 =3H2O+2 Cu2++CO2↑(已知Cu2(OH)2CO3不易溶于水).
(6)写出步骤③生成Cu2(OH)2CO3的离子方程式2Cu2++4HCO3-=Cu2(OH)2CO3↓+H2O+3 CO2↑.
| A. | 按系统命名法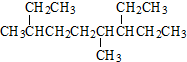 的名称为:4,7-二甲基-3-乙基辛烷 的名称为:4,7-二甲基-3-乙基辛烷 | |
| B. | 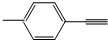 分子中所有原子共平面 分子中所有原子共平面 | |
| C. | 肌醇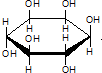 与葡萄糖的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,二者均属于糖类化合物 与葡萄糖的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,二者均属于糖类化合物 | |
| D. | 1.0 mol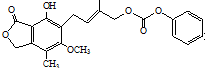 最多能与含5 mol NaOH的水溶液完全反应 最多能与含5 mol NaOH的水溶液完全反应 |
| A. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 分子间作用力比化学键弱得多,但它对物质熔点、沸点有较大影响,而对溶解度无影响 | |
| D. | ${\;}_{\;}^{14}$C可用于文物年代的鉴定,${\;}_{\;}^{14}$C与${\;}_{\;}^{12}$C互为同素异形体 |
 有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题:
有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题: ,YQ3中心原子的杂化类型为sp2,Z与Q两元素第一电离能的大小关系:Z<Q(填“>”、“<”或“=”).
,YQ3中心原子的杂化类型为sp2,Z与Q两元素第一电离能的大小关系:Z<Q(填“>”、“<”或“=”). ,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.