题目内容
14.已知反应:FeS+2H+=Fe2++H2S↑,2H2S+3O2═2SO2+2H2O(1)将24g 铁粉和8g 硫粉混合均匀,在隔绝空气条件下加热充分反应.然后往反应产物中加入足量稀硫酸,产生标准状况下的气体体积(忽略气体的溶解)为9.6L;若使该气体完全燃烧,消耗标准状况下空气的体积为(空气中O2的体积分数为0.20)52L.
(2)将a g 铁粉和bg 硫粉混合均匀,在隔绝空气条件下充分加热.然后往反应产物中加入足量稀硫酸,将产生的气体完全燃烧,消耗标准状况下的空气V L,则V的取值范围为a<V≤3a.
分析 (1)根据反应:Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,FeS+H2SO4=FeSO4+H2S↑,Fe+H2SO4=FeSO4+H2↑,产生的气体物质的量之和与铁的物质的量相同,据此计算;
(2)金属铁和硫之间的反应分为两种情况:金属铁量不足,金属铁过量,前一种情况下,生成的气体只有硫化氢,后一种情况下,产生的气体是硫化氢和氢气的混合物,据此结合反应分析讨论得到答案.
解答 解:(1)将24g铁粉和8g硫粉混合均匀,在隔绝空气条件下加热充分反应.铁过量,然后往反应产物中加入足量稀硫酸,故有气体H2S和H2产生
Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,FeS+H2SO4=FeSO4+H2S↑,Fe+H2SO4=FeSO4+H2↑所以气体物质的量之和与铁的物质的量相同,体积就是22.4L/mol×$\frac{24}{56}$mol=9.6L.
Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,
56 32 88
14g 8g 22g
生成的FeS是22g即0.25mol,根据 Fe~H2,FeS~H2S,所以得到硫化氢是0.25mol,即5.6L,完全燃烧消耗氧气0.375mol,体积是0.375mol×22.4L/mol=8.4L,
氢气是4L,会消耗氧气2L,共消耗氧气8.4L+2L=10.4L,消耗空气的体积是10.4L×5=52L,故答案为:9.6;52;
(2)过程中可能发生的反应:Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,FeS+H2SO4=FeSO4+H2S↑,Fe+H2SO4=FeSO4+H2↑,2H2+O2=2H2O,2H2S+3O2=2H2O+2SO2,金属铁和硫之间的反应,当Fe过量时,根据反应原理,消耗氧气的体积是0.2aL,此时消耗空气是aL,金属铁和硫之间恰好完全反应或是金属铁量不足时,得到的气体只有硫化氢,根据反应2H2S+3O2=2H2O+2SO2,所以消耗氧气的体积是1.5aL,此时消耗空气是3aL,所以a<V≤3a,故答案为:a<V≤3a.
点评 本题是一道有关范围讨论的计算题,设计金属铁以及含硫物质的性质知识,注意解题的思路的方法是关键,难度中等.

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案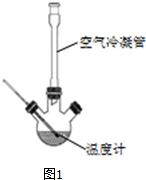 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.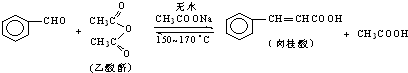
药品物理常数
| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
| 沸点(℃) | 179.6 | 138.6 | 300 | 118 |
| 相对分子质量 | 106 | 102 | 148 | 60 |
Ⅰ、合成:反应装置如图1所示.向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀.在150~170℃加热1小时,保持微沸状态.
(1)空气冷凝管的作用是使反应物冷凝回流.
(2)该装置的加热方法是空气浴(或油浴).加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是乙酸酐蒸出,反应物减少,平衡左移.
(3)不能用醋酸钠晶体(CH3COONa•3H2O)的原因是乙酸酐遇热水水解.
Ⅱ、粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:

(4)加饱和Na2CO3溶液除了转化醋酸,主要目的是将肉桂酸转化为肉桂酸钠,溶解于水.
(5)操作I是冷却结晶;若所得肉桂酸晶体中仍然有杂质,欲提高纯度可以进行的操作是重结晶(均填操作名称).
(6)设计实验方案检验产品中是否含有苯甲醛取样,加入银氨溶液共热,若有银镜出现,说明含有苯甲醛,或加入用新制氢氧化铜悬浊液,若出现砖红色沉淀,说明含有苯甲醛.
(7)若最后得到纯净的肉桂酸5.0g,则该反应中的产率是75%(保留两位有效数字)
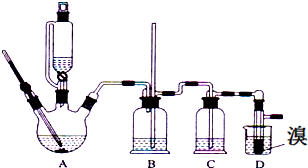
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的两步反应方程式为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;CH2=CH2+Br-Br→CH2Br-CH2Br
(2)装置B中玻璃管的作用控制气体流速,防止危险
(3)装置C中加入氢氧化钠溶液,其目的是吸收反应中生成的SO2、CO2气体 (填分子式)
(4)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(6)若产物中有少量未反应的Br2,最好用NaOH溶液试剂除去;
(7)若产物中有少量副产物乙醚.可用蒸馏方法除去.
| A. | pH=4的醋酸 | B. | pH=10的NaOH溶液 | ||
| C. | pH=9的Na2CO3溶液 | D. | pH=2的硫酸 | ||
| E. | pH=4的NH4Cl溶液 |
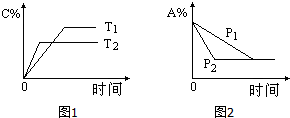 可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )| A. | T1<T2 △H>0 | B. | T1>T2 △H<0 | C. | P1<P2 a=c+d | D. | P1<P2 a+b=c+d |
| A. | 质子数为7、中子数为7的氮原子:${\;}_{7}^{7}$N | |
| B. | 氮离子(N3-)的结构示意图: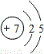 | |
| C. | 氨气分子的电子式: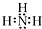 | |
| D. | 甘氨酸分子的结构简式:C2H5O2N |
| A. | 容量瓶可以用来溶解或稀释溶液 | |
| B. | 与硫酸铜溶液反应时可以取用大块的钠 | |
| C. | 可以用排饱和食盐水的方法收集氯气 | |
| D. | 制备氢氧化铁胶体时,需要不断加热和搅拌 |
| A. | H2O2、Na2O2都属于过氧化物、都存在非极性共价键 | |
| B. | H2O2做漂白剂是利用其强氧化性,漂白原理与HClO类似但与SO2不同 | |
| C. | 双氧水是绿色氧化剂,可作医疗消毒剂 | |
| D. | H2O2既有氧化性又有还原性,1molH2O2在参加反应时一定转移2mol电子 |