题目内容
19.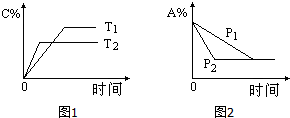 可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
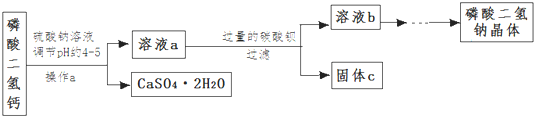
可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )| A. | T1<T2 △H>0 | B. | T1>T2 △H<0 | C. | P1<P2 a=c+d | D. | P1<P2 a+b=c+d |
分析 可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短,由图象可知T2>T1;当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短,由图象可知p2>p1;根据温度、压强对化学平衡移动的影响解答该题.
解答 解:左图中,由“先拐先平数值大”知T2>T1,升高温度,生成物的含量减小,说明平衡向逆反应方向移动,则正反应是放热反应,即△H<0;
右图中,当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短,由图象可知P2>P1,增大压强,反应物A的含量不变,说明平衡不移动,则反应前后混合气体的计量数之和不变,即a+b=c+d,
故选D.
点评 本题考查化学平衡的图象,根据“先拐先平数值大”确定温度、压强的相对大小,再结合温度、压强对化学平衡的影响来分析解答,难度不大.

练习册系列答案
相关题目
20.下列化学反应属于吸热反应的是( )
| A. | 碘的升华 | B. | 生石灰溶于水 | C. | 镁与稀盐酸反应 | D. | 氨气分解 |
11.在给定条件下,下列选项中所示的物质间转化不能一步实现的是( )
| A. | FeS2$\stackrel{O_{2}/高温}{→}$SO2$\stackrel{H_{2}O_{2}(aq)}{→}$H2SO4 | |
| B. | 饱和NaCl溶液$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | CuSO4(aq)$\stackrel{过量NaOH(aq)}{→}$Cu(OH)2$\stackrel{葡萄糖(aq)/△}{→}$Cu2O | |
| D. | 1 mol•L-1HCl(aq)$\stackrel{MnO_{2}/△}{→}$Cl2$\stackrel{石灰乳}{→}$Ca(ClO)2 |
8.下列指定微粒的数目可能不等的是( )
| A. | 等物质的量的氯气和液氯中含有的分子数 | |
| B. | 等质量的红磷和白磷中含有的原子数 | |
| C. | 同温、同体积的CO和NO的质子数 | |
| D. | 等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数 |
9.下列各组物质中,前者为强电解质,后者为弱电解质的是( )
| A. | 硫酸,二氧化硫 | B. | BaCO3,氨水 | C. | 盐酸,酒精 | D. | 熔融的氯化钾,水 |