题目内容
下列说法正确的是( )
| A、能白发进行的化学反应一定是△H<O、△S>O |
| B、已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ?mol-1,则含40.Og NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3kJ |
| C、已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1,则氢气的燃烧热为241.8kJ?mol-1 |
| D、已知2C(s)+2O2(g)═2CO2(g)△H=a kJ?mol-1、2C(s)+O2(g)═2CO(g)△H═b kJ?mol-1,则a>b |
考点:焓变和熵变,反应热和焓变
专题:化学反应中的能量变化
分析:A.反应能否自发进行取决于△H-T△S的值的大小;
B.弱电解质电离需要吸收热量;
C.燃烧热是指:1mol纯净物完全燃烧生成稳定的氧化物放出的热量;
D.相同物质的量的碳燃烧生成二氧化碳放出的热量大于燃烧生成一氧化碳放出的热量,放热反应△H<0.
B.弱电解质电离需要吸收热量;
C.燃烧热是指:1mol纯净物完全燃烧生成稳定的氧化物放出的热量;
D.相同物质的量的碳燃烧生成二氧化碳放出的热量大于燃烧生成一氧化碳放出的热量,放热反应△H<0.
解答:
解:A.反应能否自发进行取决于△H-T△S的值的大小,只要满足△H-T△S<0,反应就能自发进行,所以A错误;
B.醋酸为弱电解质,电离吸收热量,所以含40.Og NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3kJ,故B正确;
C.燃烧热是指:1mol纯净物完全燃烧生成稳定的氧化物放出的热量,氢气燃烧生成液态水更稳定,故C错误;
D.放热反应△H<0,同物质的量的碳燃烧生成二氧化碳放出的热量大于燃烧生成一氧化碳放出的热量,所以a<b,故D错误;
故选:B.
B.醋酸为弱电解质,电离吸收热量,所以含40.Og NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3kJ,故B正确;
C.燃烧热是指:1mol纯净物完全燃烧生成稳定的氧化物放出的热量,氢气燃烧生成液态水更稳定,故C错误;
D.放热反应△H<0,同物质的量的碳燃烧生成二氧化碳放出的热量大于燃烧生成一氧化碳放出的热量,所以a<b,故D错误;
故选:B.
点评:本题考了反应自发进行的判断依据、燃烧热的概念、焓变的大小比较,题目难度不大,注意比较焓变大小时应考虑焓变的正负号.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各表述与示意图一致的是( )
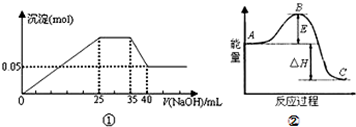

| A、图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:1:2 |
| B、图①中使用的NaOH的浓度为2mol?L-1 |
| C、图②中物质A反应生成物质C,△H>0 |
| D、图②中曲线表示某反应过程的能量变化,若使用催化剂,E值会减小 |
已知25℃时有关弱酸的电离平衡常数如下.下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×l0-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、NaHCO3溶液中,一定有c(Na+)=c(HCO3-)+c(CO32-) |
| B、将a mol?L-1HCN溶液与a mol?L-1 NaOH溶液等体积混合后,测得所得溶液显碱性(pH>7),则c(OH-)>c(H+),c(CN-)>c(Na+) |
| C、等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) |
| D、1mol/L醋酸溶液加水稀释,溶液中所有离子浓度均减小 |
下列依据热化学方程式得出的结论正确的是( )
| A、已知2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ?mol-1则氢气的燃烧热为△H=-241.8kJ?mol-1 |
| B、已知C(石墨,s)═C(金刚石,s);△H=+1.9kJ?mol-1,可知石墨比金刚石更稳定 |
| C、已知NaOH(ag)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.4kJ?mol-1可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量等于57.4kJ |
| D、已知2C(s)+2O2(g)═2CO2(g);△H1 2C(s)+O2(g)═2CO(g);△H2,则△H1>△H2 |
下列说法正确的是( )
A、化合物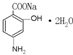 的核磁共振氢谱测出5个谱峰 的核磁共振氢谱测出5个谱峰 |
| B、实验室检验NH4HCO3溶液中NH4+的方法是取少量溶液,加热,并用湿润的红色石蕊试纸检证产生的气体,试纸变蓝,证明有NH4+ |
| C、在一定条件下,某可逆反应的△H=+100kJ?mol-1,则该反应正反应活化能比逆反应活化能大100kJ?mol-1 |
| D、等浓度的碳酸钠和碳酸氢钠溶液混合后的溶液中:2c(OH-)+c(CO32-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
下列说法错误的是( )
| A、在水溶液里,乙酸分子中的-CH3可以电离出H+ |
| B、红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 |
| C、用金属钠可区分乙醇和乙醚 |
| D、盐析可提纯蛋白质并保持其生理活性 |
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O,下列说法中,不正确的是( )
A、1molFe2+被氧化时,被Fe2+还原的O2的物质的量为
| ||
| B、x=4 | ||
| C、每生成1mol Fe3O4,反应转移的电子总数为4mol | ||
| D、S2O32-是还原剂 |
NA表示阿伏加德罗常数,有关NA的正确说法是( )
| A、1mol D318O+中含有的中子数为10NA |
| B、标准状况下,22.4L水中含O-H键数为2NA |
| C、某温度时1L pH=6的纯水所含OH-离子数为1.0×10-6NA |
| D、7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA |
下列试剂不能用玻璃瓶盛放的是( )
| A、NaOH溶液 | B、氢氟酸 |
| C、NaCl溶液 | D、稀盐酸 |