题目内容
下列各表述与示意图一致的是( )
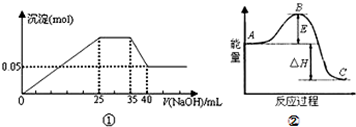

| A、图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:1:2 |
| B、图①中使用的NaOH的浓度为2mol?L-1 |
| C、图②中物质A反应生成物质C,△H>0 |
| D、图②中曲线表示某反应过程的能量变化,若使用催化剂,E值会减小 |
考点:离子方程式的有关计算,反应热和焓变
专题:图示题,计算题
分析:由图①可知,原溶液含有Mg2+、Al3+、NH4+,沉淀最大时是氢氧化镁、氢氧化铝沉淀,且n[Mg(OH)2]+n[Al(OH)3],沉淀最小时,为氢氧化镁,由图可知n[Mg(OH)2]=0.05mol,35mL-40mL发生Al(OH)3+OH-=AlO2-+2H2O,根据铝元素守恒可知n(Al3+)=n[Al(OH)3],根据Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓计算NaOH的浓度;再根据25mL-35mL发生NH4++OH-=NH3.H2O,以此分析A、B;
由图②可知,反应物的总能量大于生成物的总能量,为放热反应;E为活化能,使用催化剂,降低反应所需的活化能,而△H不变,以此分析C、D.
由图②可知,反应物的总能量大于生成物的总能量,为放热反应;E为活化能,使用催化剂,降低反应所需的活化能,而△H不变,以此分析C、D.
解答:
解:A.由图可知n[Mg(OH)2]=0.05mol,设NaOH浓度为c,由Al(OH)3+OH-=AlO2-+2H2O、n(Al3+)=n[Al(OH)3],可知n(Al3+)=0.005cmol,
根据Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,0.05mol×2+0.005cmol×3=0.025cmol,解得c=10mol/L,由NH4++OH-=NH3.H2O可知,n( NH4+)=0.01L×10mol/L=0.1mol,三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=0.05mol:0.05mol:0.1mol=1:1:2,故A错误;
B.由A的计算可知,使用的NaOH的浓度为10mol?L-1,故B错误;
C.反应物的总能量大于生成物的总能量,为放热反应,则物质A反应生成物质C,△H<0,故C错误;
D.图②中曲线表示某反应过程的能量变化,若使用催化剂,降低反应所需的活化能,而△H不变,即E值会减小,故D正确;
故选D.
根据Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,0.05mol×2+0.005cmol×3=0.025cmol,解得c=10mol/L,由NH4++OH-=NH3.H2O可知,n( NH4+)=0.01L×10mol/L=0.1mol,三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=0.05mol:0.05mol:0.1mol=1:1:2,故A错误;
B.由A的计算可知,使用的NaOH的浓度为10mol?L-1,故B错误;
C.反应物的总能量大于生成物的总能量,为放热反应,则物质A反应生成物质C,△H<0,故C错误;
D.图②中曲线表示某反应过程的能量变化,若使用催化剂,降低反应所需的活化能,而△H不变,即E值会减小,故D正确;
故选D.
点评:本题考查离子反应的计算及反应中能量变化,为高频考点,把握图中发生的反应及反应的先后顺序为解答的关键,侧重分析与计算能力的综合考查,题目难度中等.

练习册系列答案
相关题目
下列关于溶液的说法正确的是( )
| A、1L 0.2mol/L CaCl2溶液中,Cl-数目约为0.2×6.02×1023个 |
| B、50mL 1mol/L AlCl3溶液与100mL 3mol/L KClO3溶液中的Cl-物质的量浓度相等 |
| C、0.5L 1mol/L MgCl2溶液与0.2L 1mol/L KCl溶液中的Cl-的数目之比为5:2 |
| D、在100mL Na2SO4和KNO3的混合溶液中,Na+的物质的量浓度与SO42-的物质的量浓度之比为2:1 |
下列离子方程式正确的是( )
| A、碳酸钡与盐酸反应:2H++BaCO3=Ba2++H2O+CO2↑ |
| B、氢氧化钡溶液与稀硫酸混合:Ba2++SO42-+H++OH-=BaSO4↓+H2O |
| C、氯气通入蒸馏水中:Cl2+H2O=Cl-+ClO-+2H+ |
| D、CO2通入过量的澄清石灰水中:CO2+Ca(OH)2=CaCO3↓+H2O |
下列说法正确的是( )
| A、液氯比氯水有更强的漂白性 |
| B、实验室Cl2时,可用饱和Na2CO3溶液除去其中的HCl |
| C、新制氯水应保存在棕色试剂瓶中 |
| D、漂白粉的有效成分是CaCl2和Ca(ClO)2 |
下列推断正确的是( )
| A、SiO2能与NaOH溶液、HF溶液反应,所以SiO2是两性氧化物 |
| B、新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
| C、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D、Na2O、Na2O2组成元素相同,阳离子与阴离子个数比也相同 |
下列物质按照混合物、非电解质、碱、酸式盐的顺序排列正确的是( )
| A、漂白粉、Cl2、氨水、NaHCO3 |
| B、福尔马林、苯、Cu2(OH)2CO3、明矾 |
| C、食醋、C2H5OH、苛性钾、NaHSO4 |
| D、盐酸、SO2、纯碱、NH4Cl |
下列溶液中的各组离子,通入过量SO2气体后仍能大量存在的是( )
| A、Ba2+、Ca2+、Cl- |
| B、OH-、CO32-、Na+ |
| C、Ca2+、CO32-、Cl- |
| D、H+、Fe3+、NO3- |
下列操作或发生事故时的处理方法正确的是( )
| A、可用燃着的酒精灯引燃另一只酒精灯 |
| B、给试管里的液体加热时,试管应与桌面垂直 |
| C、凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 |
| D、浓硫酸不慎沾在皮肤上,应立即用干布擦掉,然后用水冲洗,最后再涂上3%~5%的小苏打溶液 |
下列说法正确的是( )
| A、能白发进行的化学反应一定是△H<O、△S>O |
| B、已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ?mol-1,则含40.Og NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3kJ |
| C、已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1,则氢气的燃烧热为241.8kJ?mol-1 |
| D、已知2C(s)+2O2(g)═2CO2(g)△H=a kJ?mol-1、2C(s)+O2(g)═2CO(g)△H═b kJ?mol-1,则a>b |