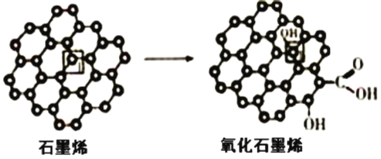
题目内容
【题目】Zn3(PO4)2·2H2O(溶于酸,难溶于水)是一种无毒害作用的防锈颜料,利用锌浮渣(主要含Zn、ZnO、ZnCl2,还含少量的铁、锰、铜、铅及砷的化合物等)制取Zn3(PO4)2·2H2O的工艺流程如图:
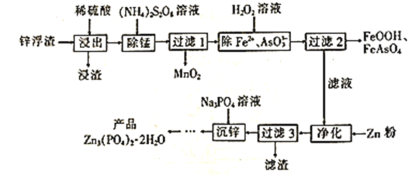
回答下列问题:
(1)“浸出”时,下列措施能提高锌的浸取率的是__(填字母)。
A.用浓硫酸代替稀硫酸 B.适当升高浸取液的温度
C.将“浸渣”再次浸取 D.缩短“浸出”时间
(2)“除锰”时,Mn2+发生反应的离子方程式为__(S2O![]() 被还原为SO
被还原为SO![]() )。
)。
(3)流程中除铁、砷时,当生成8.9gFeOOH和7.8gFeAsO4时,消耗H2O2__mol。
(4)“净化”时加锌粉的目的是__。
(5)“沉锌”时发生反应的化学方程式为__。
(6)“沉锌”至得到“产品”还需要经过的操作是__、洗涤、__。证明产品已洗涤干净的实验方法是__。
(7)Meyer等认为磷酸锌防腐机理是在钢铁表面形成组成近似为Zn2Fe(PO4)2·4H2O的覆盖膜,则在形成该覆盖膜的过程中,负极的电极反应式为__。
【答案】BC Mn2++S2O![]() +2H2O=MnO2↓+2SO
+2H2O=MnO2↓+2SO![]() +4H+ 0.09 置换出铅 3ZnSO4+2Na3PO4+2H2O=Zn3(PO4)2·2H2O↓+3Na2SO4 过滤 干燥 取最后一次的洗涤液少许于试管中,加入盐酸酸化的
+4H+ 0.09 置换出铅 3ZnSO4+2Na3PO4+2H2O=Zn3(PO4)2·2H2O↓+3Na2SO4 过滤 干燥 取最后一次的洗涤液少许于试管中,加入盐酸酸化的![]() 溶液,若不产生沉淀,说明已洗涤干净 Fe-2e-=Fe2+
溶液,若不产生沉淀,说明已洗涤干净 Fe-2e-=Fe2+
【解析】
锌浮渣经过稀硫酸浸出时,锌浮渣中Zn、ZnO、ZnCl2、铁、锰、铅会与稀硫酸反应生成ZnSO4、FeSO4、MnSO4、PbSO4,而砷的化合物会与稀硫酸反应生成H3AsO3,铜不与稀硫酸反应,因此浸渣为铜;在上述浸出得到的液体中加入(NH4)S2O8, (NH4)S2O8会MnSO4发生离子反应:Mn2++S2O![]() +2H2O=MnO2↓+2SO
+2H2O=MnO2↓+2SO![]() +4H+,经过滤1即可除去固体MnO2;在过滤1后的溶液中加入H2O2溶液,随着H2O2溶液的加入会发生如下离子反应:
+4H+,经过滤1即可除去固体MnO2;在过滤1后的溶液中加入H2O2溶液,随着H2O2溶液的加入会发生如下离子反应:![]() ,
, ![]() ,同时,H3AsO3在氧化剂存在条件下被氧化成H3AsO4,方程式为
,同时,H3AsO3在氧化剂存在条件下被氧化成H3AsO4,方程式为![]() ,在净化过程中
,在净化过程中![]() 会和
会和![]() 发生离子反应:
发生离子反应:![]() ,经过过滤2就可以除去
,经过过滤2就可以除去![]() 、
、![]() ;过滤2得到的滤液中还剩余ZnSO4、PbSO4,锌比铅活泼,因此可以通过加入锌粉净化PbSO4,同时还不加入新杂质,反应的离子方程式为:
;过滤2得到的滤液中还剩余ZnSO4、PbSO4,锌比铅活泼,因此可以通过加入锌粉净化PbSO4,同时还不加入新杂质,反应的离子方程式为:![]() ,经过过滤3即可得到滤渣铅单质;经过过滤3得到的滤液中只剩下ZnSO4,往该溶液中加入Na3PO4发生反应,3ZnSO4+2Na3PO4+2H2O=Zn3(PO4)2·2H2O↓+3Na2SO4,将得到的沉淀物质用水洗涤数次,用氯化钡检验硫酸根离子,直到无硫酸根离子时,即可压滤得到成品Zn3(PO4)2·2H2O;据上述过程解答。
,经过过滤3即可得到滤渣铅单质;经过过滤3得到的滤液中只剩下ZnSO4,往该溶液中加入Na3PO4发生反应,3ZnSO4+2Na3PO4+2H2O=Zn3(PO4)2·2H2O↓+3Na2SO4,将得到的沉淀物质用水洗涤数次,用氯化钡检验硫酸根离子,直到无硫酸根离子时,即可压滤得到成品Zn3(PO4)2·2H2O;据上述过程解答。
(1)A.用浓硫酸代替稀硫酸,铁会钝化不反应,降低浸出率, A项错误;
B.浸出率与液固比、浸出时间、搅拌时间、浸出温度有关,适当升高浸取液的温度,可以提高浸出率,B项正确;
C.将“浸渣”再次浸取,可以提高浸出率,C项正确;
D.缩短“浸出”时间,反应不充分时,会降低浸出率,D项错误;
故答案为:BC;
(2)据流程图可知,用稀硫酸浸出得到的液体中含有MnSO4,“除锰”时,加入(NH4)S2O8得到MnO2,故“除锰”发生离子反应为:Mn2++S2O![]() +2H2O=MnO2↓+2SO
+2H2O=MnO2↓+2SO![]() +4H+。故答案为:Mn2++S2O
+4H+。故答案为:Mn2++S2O![]() +2H2O=MnO2↓+2SO
+2H2O=MnO2↓+2SO![]() +4H+;
+4H+;
(3)流程中除铁、砷时,在过滤1后的溶液中加入H2O2溶液,随着H2O2溶液的加入会发生如下离子反应:![]() ,
,![]() ,同时H3AsO3在氧化剂存在条件下被氧化成H3AsO4,方程式为
,同时H3AsO3在氧化剂存在条件下被氧化成H3AsO4,方程式为![]() ,在净化过程中
,在净化过程中![]() 会和
会和![]() 发生离子反应:
发生离子反应:![]() ,由上方程式可知当生成8.9gFeOOH和7.8gFeAsO4时,存在关系式
,由上方程式可知当生成8.9gFeOOH和7.8gFeAsO4时,存在关系式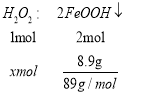 ,
,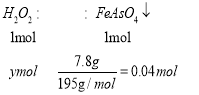 ,解得x=0.05mol,y=0.04mol,因此消耗H2O2共0.09mol。故答案为:0.09;
,解得x=0.05mol,y=0.04mol,因此消耗H2O2共0.09mol。故答案为:0.09;
(4)过滤2得到的滤液中还剩余ZnSO4、PbSO4,锌比铅活泼,因此可以通过加入锌粉置换出Pb,同时还不加入新杂质。故答案为:置换出铅;
(5)经过过滤3得到的溶液中只剩下Zn SO4,“沉锌”时往该溶液中加入Na3PO4发生反应:3ZnSO4+2Na3PO4+2H2O=Zn3(PO4)2·2H2O↓+3Na2SO4。故答案为:3ZnSO4+2Na3PO4+2H2O=Zn3(PO4)2·2H2O↓+3Na2SO4;
(6)由“沉锌”发生的反应可知,“沉锌”得到“产品”还含有部分杂质Na2SO4和水,过滤后需要再洗涤多次,把杂质洗干净之后才能干燥得到纯净的固体Zn3(PO4)2·2H2O;洗涤过程中,可以通过检验最后一次过滤的滤液中是否还含有硫酸根离子来验证产品是否已洗涤干净,验证硫酸根的办法是取最后一次的洗涤液少许于试管中,加入盐酸酸化的![]() 溶液,若不产生沉淀,说明已洗涤干净。故答案为:过滤;干燥;取最后一次的洗涤液少许于试管中,加入盐酸酸化的
溶液,若不产生沉淀,说明已洗涤干净。故答案为:过滤;干燥;取最后一次的洗涤液少许于试管中,加入盐酸酸化的![]() 溶液,若不产生沉淀,说明已洗涤干净;
溶液,若不产生沉淀,说明已洗涤干净;
(7)磷酸锌防腐机理是在钢铁表面形成组成近似为Zn2Fe(PO4)2·4H2O的覆盖膜,则在形成该覆盖膜的过程中,钢铁里的活泼金属铁做负极,失电子变成亚铁离子,负极的电极反应式为Fe-2e-=Fe2+。故答案为:Fe-2e-=Fe2+。

 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
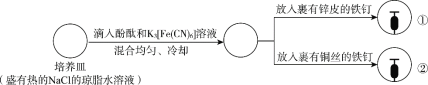
名校作业本系列答案【题目】下列根据实验操作及现象进行的分析和推断中,不正确的是
操作 |
|
现象 | 一段时间后:①中,铁钉裸露在外的附近区域变红; ②中…… |
A.NaCl的琼脂水溶液为离子迁移的通路
B.①中变红是因为发生反应2H++2e-=H2↑,促进了水的电离
C.②中可观察到铁钉裸露在外的附近区域变蓝,铜丝附近区域变红
D.①和②中发生的氧化反应均可表示为M—2e-=M2+(M代表锌或铁)