题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.50 g 34%H2O2溶液中含H-O键的数目为NA
B.180 g淀粉完全水解生成葡萄糖的分子数为NA
C.1 L 0.1 mol·L-1K2SiO3溶液中含SiO32-的数目为0.1NA
D.反应5NaClO2+4HCl=4ClO2↑+5NaCl+2H2O,每生成1 mol ClO2转移电子的数目为NA
【答案】D
【解析】
A.50 g 34%H2O2溶液中,H2O2和H2O中都有H-O键,H2O2的物质的量为50g×34%÷34g/mol=0.5mol,H2O的物质的量为50g×(1-34%)÷18g/mol=1.83mol, H2O2中的H-O键的数目为NA,水中H-O键的数目约为3.66NA,A错误;
B.180g淀粉(C6H10O5)n的物质的量为![]() mol,根据(C6H10O5)n
mol,根据(C6H10O5)n![]() nC6H12O6,可生成C6H12O6的物质的量为
nC6H12O6,可生成C6H12O6的物质的量为![]() mol
mol ![]() 1.11mol,B错误;
1.11mol,B错误;
C.由于SiO32-水解,1 L 0.1 mol·L-1 K2SiO3溶液中含SiO32-的数目小于0.1NA,C错误;
D.反应中Cl元素的化合价由反应前的+3价(NaClO2)变为反应后的+4价(ClO2),每个Cl原子失去1个电子,故每生成1 mol ClO2转移电子的数目为NA,D正确;
故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】中科院大连化学物理研究所的一项最新成果实现了甲烷高效生产乙烯,如图所示,甲烷在催化作用下脱氢,在不同温度下分别形成![]() 等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)
等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)

物质 | 燃烧热/(kJmol-1) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.0 |
(1)已知相关物质的燃烧热如上表所示,写出甲烷制备乙烯的热化学方程式______________。
(2)现代石油化工采用Ag作催化剂,可实现乙烯与氧气制备X(分子式为C2H4O,不含双键)该反应符合最理想的原子经济,则反应产物是____________(填结构简式)
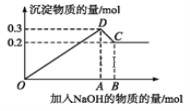
(3)在400℃时,向初始体积为1L的恒压密闭反应,器中充入1 mol CH4,发生(1)中反应,测得平衡混合气体中C2H4的体积分数为25.0%。则:

①在该温度下,其平衡常数KC=____________。
②若向该反应器中通入高温水蒸气(不参加反应,高于400℃),则C2H4的产率____________。(填“增大”“减小”“不变”或“无法确定”),理由是_______________________________。
③若反应器的体积固定,不同压强下可得变化如右图所示,则压强P1,P2的大小关系是____________。

(4)实际制备C2H4时,通常存在副反应2CH4(g)![]() C2H4(g)+2H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如右图所示。在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是____________。
C2H4(g)+2H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如右图所示。在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是____________。
(5)C2H4、C2H6常常作为燃料电池的原料,请写出C2H4在NaOH溶液中做燃料电池的负极的电极反应方程式________________________________________________。
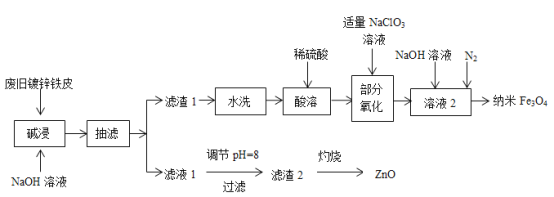
【题目】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)之后才能排放。
(1)CO和H2可作为能源和化工原料,应用十分广泛。 反应CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.5 kJ·mol1
2NO(g) ΔH=+180.5 kJ·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ·mol1
2NO2(g) ΔH=116.5 kJ·mol1
回答下列问题:
①CO的燃烧热为 _________。 若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为_________kJ。
②写出CO将NO2还原为单质反应的热化学方程式为__________________________________________
(3)汽车排气管上的催化转化器,发生上述的CO将NO2还原为单质反应。在一定温度下,将一定量的CO和NO2充入2L固定容积的容器中,回答以下问题:
①从反应开始到5min,生成了0.08mol N2,则5min内υ(CO)=___________________molL1min1。
②25min时,物质浓度变化如图所示,则改变的条件可能是___________(填字母标号)。
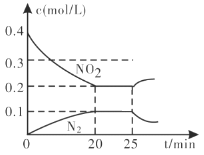
A.缩小容器体积 B.增加NO2的浓度 C.降低温度 D.升高温度
【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。在适当的条件下,将CO2转化为甲醇、甲醚等有机物,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH1=484 kJ/mol
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
则2CH3OH(g)+3O2(g)= 2CO2(g)+4H2O(g) ΔH,ΔH=____。
(2)已知T K时,某恒容密闭容器中存在如下反应:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如表所示:
c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
开始时 | a | b | 0 | 0 |
10 s时 | 3 | 0.5 | c | 1.5 |
①若反应开始到10s时间段内,v(H2)=____。
②若TK时,化学平衡常数K=15,则10s时v(正)___v(逆)(填“>”“<”或“=”),此时CO2的转化率为____。
(3)一定条件下,向某恒容密闭容器中充入x mol CO2和ymolH2,发生的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为___(填“a”或“b”)。
CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为___(填“a”或“b”)。