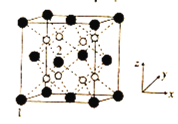
题目内容
【题目】一种钾离子电池的工作原理如图所示,下列说法正确的是

A.放电时,负极的电极反应式 :KC6 –e- =K ++6C
B.充电时,阳极的电极反应式 :K0.5-xMnO2+xK++ xe-=K0.5MnO2
C.放电时,K+ 通过阳离子交换膜向石墨电极移动
D.若仅把钾离子换成锂离子,当负极减少的质量相同时,钾离子电池转移的电子数比锂离子电池的多
【答案】A
【解析】
据图可知放电时总反应为K0.5-xMnO2+xKC6 =K0.5MnO2+6xC,该过程中K→K+被氧化,为负极,即放电时石墨电极为负极,则充电时发生还原反应为阴极;Mn元素化合价降低被还原,所以K0.5MnO2放电时为正极,充电时为阳极。
A.放电时,石墨电极为负极,附着在石墨上的K失电子被氧化成K+,结合总反应可知电极方程式为KC6 –e- =K++6C,故A正确;
B.充电时为电解池,K0.5MnO2为阳极,阳极失电子发生氧化反应,电极方程式为K0.5MnO2-xe-= K0.5-xMnO2+xK+,故B错误;
C.放电时为原电池,原电池电解质中阳离子流向正极,K0.5MnO2为正极,所以K+ 通过阳离子交换膜向K0.5MnO2电极移动,故C错误;
D.钾离子电池放电时负极反应为KC6 –e- =K++6C,锂离子电池放电时负极反应为LiC6 –e- =Li++6C,相同质量的锂和钾,锂的物质的量更大,转移的电子更多,故D错误;
故答案为A。

 阅读快车系列答案
阅读快车系列答案【题目】2014年,全国很多地区都曾出现严重的雾霾天气,汽车尾气、冬季取暖排放的CO2等都是形成雾霾的因素。请回答下列问题:
将不同物质的量的H2O(g)和CO分别通入容积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)![]() CO2(g)+H2(g),得到3组数据如表所示:
CO2(g)+H2(g),得到3组数据如表所示:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡状态所需时间/min | ||
H2O | CO | CO | H2 | |||
1 | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
2 | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
3 | 900 | a | b | c | d | t |
(1)实验1中0~5min内,以v(CO2)表示的化学反应速率为______,此温度下的化学平衡常数为______,温度升高时化学平衡常数会_______(填“增大”“减小”或“不变”)。
(2)若a=2,b=1,则达到平衡状态时实验2中H