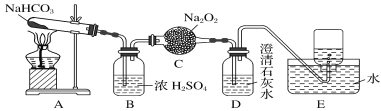
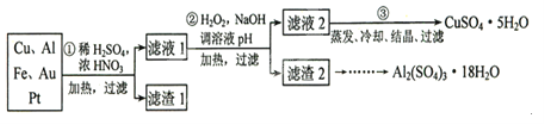
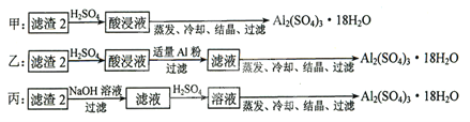
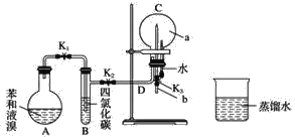
题目内容
【题目】某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g)![]() cC(g) △H= -Q kJmol-1(Q>0),12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示。试计算:
cC(g) △H= -Q kJmol-1(Q>0),12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示。试计算:
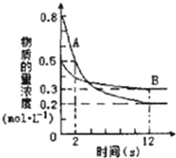
(1)前12s内,A的平均反应速率为______________。
(2)化学计量数之比b:c=______________。
(3)12s内,A和B反应放出的热量为__________(用Q表示)。
【答案】0.05mol/(L·s) 1:2 0.4Q kJ
【解析】
(1)据图象分析可以知道A的浓度变化量,根据v=c/t计算出A的平均反应速率;
(2)根据速率之比和系数成正比,计算出B、C物质的反应速率,进而计算出化学计量数之比b:c的数值;
(3)12s内,反应3molA放热QkJ,反应A的物质的量=(0.8mol/L-0.2mol/L)×2L=1.2mol,结合化学方程式定量关系计算分析。
(1)某温度下,在2L密闭容器中投入一定量的A、B发生反应: 3A(g)+bB(g)![]() cC(g) △H= -Q kJmol-1(Q>0), 12s时达到平衡,生成C的物质的量为0.8mol ,据图象分析可以知道A的浓度变化=0.8mol/L-0.2mol/L=0.6mol/L,反应速率v=c/t=0.6mol/L÷12s= 0.05mol/(L·s) ;
cC(g) △H= -Q kJmol-1(Q>0), 12s时达到平衡,生成C的物质的量为0.8mol ,据图象分析可以知道A的浓度变化=0.8mol/L-0.2mol/L=0.6mol/L,反应速率v=c/t=0.6mol/L÷12s= 0.05mol/(L·s) ;
答案是:0.05mol/(L·s);
(2)图象分析B的浓度变化=0.5mol/L-0.3mol/L=0.2mol/L,计算B的反应速率=0.2mol/L÷12s= 1/60 mol/(L·s),速率之比等于化学方程式计量数之比,3:b=0.05: 1/60,b=1,3:c=0.05:0.8mol/(2L×12s),c=2;化学计量数之比b:c=1:2;
故答案是:1:2;
(3)12s内,反应3molA放热QkJ,反应A的物质的量=(0.8mol/L-0.2mol/L)×2L=1.2mol,结合化学方程式定量关系计算:3A(g)+bB(g)![]() cC(g) △H= -Q kJmol-1(Q>0),1.2molA反应放出热量0.4QkJ;
cC(g) △H= -Q kJmol-1(Q>0),1.2molA反应放出热量0.4QkJ;
故答案是:0.4Q kJ。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案