题目内容
【题目】碳是形成单质和化合物最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)C原子的价电子轨道表达式为__。
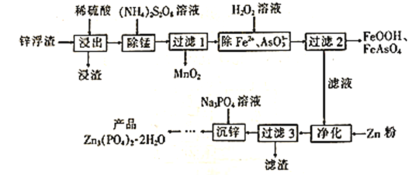
(2)碳可以形成多种有机化合物,如图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。
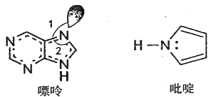
①嘌呤中所有元素的电负性由大到小的顺序__。
②吡啶结构中N原子的杂化方式是___。
③NH3的键角__PH3的键角,理由是__。
④分子中的大π键可以用符号π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为__。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为__。
(3)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯。
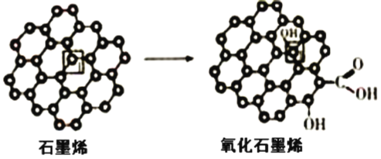
石墨烯转化为氧化石墨烯时,1号C与相邻C原子间键能的变化是__(填“变大”、“变小”“不变”)。
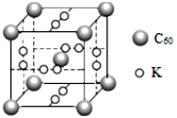
(4)石墨烯可转化为富勒烯(C60),C60和K能形成新型化合物,其晶胞如图所示,晶胞参数为anm该化合物中K原子和C60分子的个数比为___,该晶体的密度ρ=___g/cm3(阿伏加德罗常数为6.02×1023)。
【答案】![]() N>C>H(或NCH) sp3 > 两者组成和结构相似,由于中心原子N的电负性大于P,成键电子对离N原子更近(或N原子周围的电子云密度大),故NH3中成键电子对之间的斥力大,因此NH3的键角大于PH3的键角
N>C>H(或NCH) sp3 > 两者组成和结构相似,由于中心原子N的电负性大于P,成键电子对离N原子更近(或N原子周围的电子云密度大),故NH3中成键电子对之间的斥力大,因此NH3的键角大于PH3的键角 ![]() 变小 3:1
变小 3:1 ![]()
【解析】
根据原子核外电子排布规律分析C原子的价电子轨道表达式,根据元素周期律分析元素电负性,根据杂化轨道理论分析原子杂化方式和比较不同分子的键角大小关系,根据均摊法确定原子个数比并进行相关计算。
(1)C原子为元素周期表第6号元素,其核外电子排布式为1s22s22p2,则价电子轨道表达式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)①根据嘌呤的结构可知,该分子含有C、N、H三种元素,电负性大小顺序为N>C>H,故答案为:N>C>H(或NCH);
②吡啶分子中N原子形成三个共价单键,采用sp3杂化,故答案为:sp3;
③NH3和PH3组成和结构相似,由于中心原子N的电负性大于P,成键电子对离N原子更近(或N原子周围的电子云密度大),故NH3中成键电子对之间的斥力大,因此NH3的键角大于PH3的键角,故答案为:两者组成和结构相似,由于中心原子N的电负性大于P,成键电子对离N原子更近(或N原子周围的电子云密度大),故NH3中成键电子对之间的斥力大,因此NH3的键角大于PH3的键角;
④由吡啶的结构分析可知,该吡啶分子中4个C原子和1个N原子参与形成大π键,4个C原子各提供一个电子,1各N原子提供一对孤对电子,因此该吡啶中的大π键表示为![]() ,故答案为:
,故答案为:![]() ;
;
(3)石墨烯转化为氧化石墨烯时,1号C连接的O原子吸引电子能力较强,导致与1号C原子相邻C原子对电子的吸引力减小,所以1号C与相邻C原子间键能的变化是变小,故答案为:变小;
(4)根据晶胞结构可知,K原子位于晶胞的面上,由均摊法,1个晶胞中K原子的个数为![]() ,C60分子位于晶胞的顶点和体内,1个晶胞中C60分子的个数为
,C60分子位于晶胞的顶点和体内,1个晶胞中C60分子的个数为![]() ,则该化合物中K原子和C60分子的个数比为3:1,一个该晶胞的质量为
,则该化合物中K原子和C60分子的个数比为3:1,一个该晶胞的质量为![]() ,体积为(a3×10-21)cm3,根据公式
,体积为(a3×10-21)cm3,根据公式![]() 可得,该晶体的密度
可得,该晶体的密度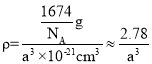 ,故答案为:
,故答案为:![]() 。
。

 53随堂测系列答案
53随堂测系列答案【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
【题目】2014年,全国很多地区都曾出现严重的雾霾天气,汽车尾气、冬季取暖排放的CO2等都是形成雾霾的因素。请回答下列问题:
将不同物质的量的H2O(g)和CO分别通入容积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)![]() CO2(g)+H2(g),得到3组数据如表所示:
CO2(g)+H2(g),得到3组数据如表所示:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡状态所需时间/min | ||
H2O | CO | CO | H2 | |||
1 | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
2 | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
3 | 900 | a | b | c | d | t |
(1)实验1中0~5min内,以v(CO2)表示的化学反应速率为______,此温度下的化学平衡常数为______,温度升高时化学平衡常数会_______(填“增大”“减小”或“不变”)。
(2)若a=2,b=1,则达到平衡状态时实验2中H