题目内容
12.下列各组物质中,化学键类型和晶体类型都完全相同的是( )| A. | 干冰和金刚石 | B. | K2CO3和KCl | C. | Na2O和Na2O2 | D. | H2SO4和HCl |
分析 一般来说,活泼金属和活泼非金属元素之间存在离子键,非金属元素之间易形成共价键.
解答 解:A.干冰是共价键形成的分子晶体和金刚石是共价键结合形成的原子晶体,故A错误;
B.K2CO3中含有共价键和离子键的离子晶体,KCl只含离子键的离子晶体,故B错误;
C.Na2O含有离子键的离子化合物,Na2O2中只含非极性共价键和离子键的离子化合物,故C错误;
D.H2SO4和HCl中只含有极性共价键的共价化合物,故D正确;
故选D.
点评 本题考查了化学键的判断,注意离子键和共价键的区别,注意由金属元素和非金属元素形成的化合物不一定是离子化合物,如氯化铝.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
2.某校化学小组学生利用如图所示装置进行“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO.(图中夹持装置及尾气处理装置均已略去)
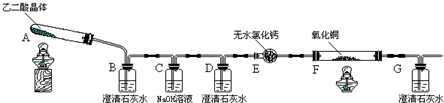
(1)装置C中盛放NaOH溶液的作用是吸收乙二酸晶体受热分解生成的二氧化碳
(2)①证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊
②证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊
(3)实验结束后,装置F中黑色氧化铜变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量固体与试管中,加稀硫酸,若溶液变蓝色,说明有Cu2O,若溶液不变色,则不含有Cu2O
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化.KMnO4和草酸钠在稀硫酸中反应的离子方程式是2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
KMnO4溶液的物质的量浓度的计算式是c(KMnO4)=$\frac{0.2000g×2mol}{5mol×134g/mol×0.01601L}$.

(1)装置C中盛放NaOH溶液的作用是吸收乙二酸晶体受热分解生成的二氧化碳
(2)①证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊
②证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊
(3)实验结束后,装置F中黑色氧化铜变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量固体与试管中,加稀硫酸,若溶液变蓝色,说明有Cu2O,若溶液不变色,则不含有Cu2O
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化.KMnO4和草酸钠在稀硫酸中反应的离子方程式是2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
3.在Zn+HNO3→Zn(NO3)2+NH4NO3+H2O的反应中,如果2mol Zn完全起反应,则被还原的HNO3的物质的量是( )
| A. | 0.5mol | B. | 1mol | C. | 2mol | D. | 5mol |
20.下列离子方程式书写正确的是( )
| A. | 浓氢氧化钠溶液中加入铝Al+2OH-═AlO2-+H2↑ | |
| B. | 氯化铝溶于水发生水解Al3++3H2O═Al(OH)3+3H+ | |
| C. | 明矾溶液中加入少量的氢氧化钡溶液Al3++3OH-═Al(OH)3↓ | |
| D. | 硫酸铝溶液中加入过量氢氧化钠溶液Al3++4OH-═AlO2-+2H2O |
17.将硫化氢通入不同浓度的硝酸溶液中,发生下列反应:
①3H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$3S↓+2NO↑+4H2O
②H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$S↓+2NO2↑+2H2O
③4H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$4S↓+NH4NO3+3H2O
④5H2S+2HNO3═5S↓+N2↑+6H2O
结合所学有关硝酸的知识,判断硝酸浓度由大到小的顺序正确的是( )
①3H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$3S↓+2NO↑+4H2O
②H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$S↓+2NO2↑+2H2O
③4H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$4S↓+NH4NO3+3H2O
④5H2S+2HNO3═5S↓+N2↑+6H2O
结合所学有关硝酸的知识,判断硝酸浓度由大到小的顺序正确的是( )
| A. | ①>②>③>④ | B. | ②>①>④>③ | C. | ②>①>③>④ | D. | ④>③>①>② |
4.根据原子结构及元素周期律的知识,下列叙述正确的是( )
| A. | 标准状况下,HF为液态,是因为氢氟键很稳定 | |
| B. | N最外层有5个电子,所以负化合价只有-3价 | |
| C. | 硅和锗处于金属与非金属的过渡位置,硅和锗都可用作半导体材料 | |
| D. | Cl-、S2-、Ca2+、K+半径逐渐减小 |
1.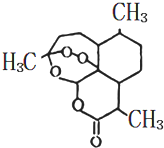 我国科学家屠呦呦因发现并成功提取出青蒿素(一种治疗疟疾的药物)而获得2015年诺贝尔生理学或医学奖.青蒿素结构简式如图(结构中有过氧键,与H2O2有相似的化学性质),下列关于青蒿素的说法不正确的是( )
我国科学家屠呦呦因发现并成功提取出青蒿素(一种治疗疟疾的药物)而获得2015年诺贝尔生理学或医学奖.青蒿素结构简式如图(结构中有过氧键,与H2O2有相似的化学性质),下列关于青蒿素的说法不正确的是( )
 我国科学家屠呦呦因发现并成功提取出青蒿素(一种治疗疟疾的药物)而获得2015年诺贝尔生理学或医学奖.青蒿素结构简式如图(结构中有过氧键,与H2O2有相似的化学性质),下列关于青蒿素的说法不正确的是( )
我国科学家屠呦呦因发现并成功提取出青蒿素(一种治疗疟疾的药物)而获得2015年诺贝尔生理学或医学奖.青蒿素结构简式如图(结构中有过氧键,与H2O2有相似的化学性质),下列关于青蒿素的说法不正确的是( )| A. | 属于有机物 | |
| B. | 青蒿素具有一定的氧化性 | |
| C. | 青蒿素化学式为C15H20O5 | |
| D. | 青蒿素在一定的条件下能与NaOH溶液反应 |
 ;
; .
.