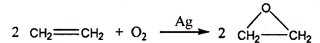题目内容
16.根据所学知识填空(1)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例饿混合而成,爆炸时的反应方程式为S+2KNO3+3C=K2S+N2↑+3CO2↑
(2)铜在空气中生成碱式碳酸铜的反应方程式为2Cu+O2+H20+CO2=Cu2(OH)2CO3
(3)工业上用粗硅制纯硅的常用方法是(用化学方程表示)Si(粗)+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4、2H2+SiCl4$\frac{\underline{\;高温\;}}{\;}$Si(纯)+4HCl
(4)石灰法是目前应用广泛的工业废气脱硫方法,有关反应的化学方程式是2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2
(5)管道工人曾经用浓氨水检验氯气管道是否漏气,如果氯气管道某处漏气,写出检验过程中反应的化学方程式2NH3+3Cl2=6HCl+N2、NH3+HCl=NH4Cl.
分析 (1)硫磺粉、硝酸钾和木炭按一定比例混合而成的,爆炸时会产生N2、CO2,根据反应物和生成物可确定方程式;
(2)铜和水、氧气、二氧化碳反应生成碱式碳酸铜;
(3)粗硅在高温下与氯气(Cl2)反应生成四氯化硅,四氯化硅在高温下与氢气反应,得到高纯度的硅;
(4)石灰高温下与废气中的SO2与O2化合生成CaSO4、CO2;
(5)如果氯气管道某处漏气,会出现白烟现象,说明有氯化铵生成,则氨气和氯气反应有HCl生成,根据氧化还原反应知,还生成氮气.
解答 解:(1)硫磺粉、硝酸钾和木炭按一定比例混合而成的,爆炸时会产生N2、CO2,反应的方程式为S+2KNO3+3C=K2S+N2↑+3CO2↑,
故答案为:S+2KNO3+3C=K2S+N2↑+3CO2↑;
(2)铜和水、氧气、二氧化碳反应生成碱式碳酸铜,故反应的化学方程式为:2Cu+O2+H20+CO2=Cu2(OH)2CO3,
故答案为:2Cu+O2+H20+CO2=Cu2(OH)2CO3;
(3)硅在高温下与氯气(Cl2)反应生成四氯化硅:Si(粗)+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4,四氯化硅在高温下与氢气反应,就可以得到高纯度的硅,同时生成HCl:2H2+SiCl4$\frac{\underline{\;高温\;}}{\;}$Si(纯)+4HCl,
故答案为:Si(粗)+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4,2H2+SiCl4$\frac{\underline{\;高温\;}}{\;}$Si(纯)+4HCl;
(4)石灰(CaCO3)为脱硫剂,高温下与废气中的SO2与O2化合生成CaSO4,反应的化学方程式是:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2,
故答案为:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2;
(5)如果氯气管道某处漏气,会出现白烟现象,说明有氯化铵生成,则氨气和氯气反应有HCl生成,根据氧化还原反应知,还生成氮气,反应方程式为2NH3+3Cl2=6HCl+N2,氯化氢和氨气反应方程式为:NH3+HCl=NH4Cl,
故答案为:2NH3+3Cl2=6HCl+N2、NH3+HCl=NH4Cl.
点评 本题考查了方程式是书写,明确物质的性质是解本题关键,根据反应物、生成物及反应条件书写方程式,侧重于元素化合物知识的综合理解和运用的考查,题目难度不大.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案| A. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | 常温下,c(H+)/c(OH-)=1010的溶液中:Na+、NH4+、ClO-、I- | |
| C. | 水电离出的c(H+)=10-12mol•L-1的溶液:K+、Na+、CO32-、Br- | |
| D. | 含有0.1mol•LHCO3-的溶液:Na+、Fe3+、NO3-、SCN- |
| W | X | |
| Y | Z |
| A. | X、Y、Z中最简单氢化物稳定性最差的是Y | |
| B. | X元素形成的单核阴离子还原性强于Y | |
| C. | Z元素氧化物对应水化物的酸性强于Y | |
| D. | Y元素单质在化学反应中只表现出氧化性 |
| A. | 在空气中金属铝表面迅速氧化形成保护层 | |
| B. | 钢铁在潮湿的空气中生锈 | |
| C. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层 | |
| D. | 钢管被原油中的含硫化合物腐蚀 |
①在原溶液中滴加足量的饱和氯水后,有气泡生成,溶液呈橙黄色;
②向上述呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;
③橙黄色溶液不能使淀粉溶液变蓝色.
根据上述实验事实推断,下列说法不正确的是( )
| A. | 溶液中一定存在Br-、CO32- | B. | 溶液中一定存在NH4+ | ||
| C. | 溶液中一定不存在Fe2+、I-、SO32- | D. | 溶液中可能存在NH4+ |
| A. | 微粒半径:Mg2+>F- | B. | 稳定性:HI>HBr | ||
| C. | 酸性:H2CO3>H3PO4 | D. | 熔点:Al>Na |
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴浓硝酸 | 将铁钉放入氯化铁溶液中 |
| A. | 实验①和③中的铁钉只作还原剂 | |
| B. | 实验③中反应的离子方程式为Fe+Fe3+═2Fe2+ | |
| C. | 实验②中Fe2+既显氧化性又显还原性 | |
| D. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |
 .
.