题目内容
1.在一含Na+的澄清溶液中,可能还存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种.①在原溶液中滴加足量的饱和氯水后,有气泡生成,溶液呈橙黄色;
②向上述呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;
③橙黄色溶液不能使淀粉溶液变蓝色.
根据上述实验事实推断,下列说法不正确的是( )
| A. | 溶液中一定存在Br-、CO32- | B. | 溶液中一定存在NH4+ | ||
| C. | 溶液中一定不存在Fe2+、I-、SO32- | D. | 溶液中可能存在NH4+ |
分析 ①在原溶液中滴加足量的饱和氯水后,有气泡生成,说明溶液中含有CO32-,则一定不存在Fe2+,溶液呈橙黄色,说明可能生成I2或Br2;
②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成,说明不含SO32-;
③橙黄色溶液不能使淀粉溶液变蓝色,说明不含I-,则一定含有Br-,据此进行解答.
解答 解:①在原溶液中滴加足量的饱和氯水后,有气泡生成,说明溶液中含有CO32-,则一定不存在Fe2+,溶液呈橙黄色,说明可能生成I2或Br2;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成,说明不含SO32-;③橙黄色溶液不能使淀粉溶液变蓝色,说明不含I-,
所以溶液中一定不存在:Fe2+、I-、SO32-,一定存在Br-、CO32-,
由于没有涉及到NH4+离子的性质,则NH4+不能确定是否存在,
A.根据分析可知,溶液中一定存在Br-、CO32-,故A正确;
B.无法确定溶液中是否含有铵根离子,故B错误;
C.根据分析可知,溶液中一定不存在Fe2+、I-、SO32-,故C正确;
D.溶液中可能含有NH4+,故D正确;
故选B.
点评 本题考查离子的检验,题目难度不大,明确常见离子的性质为解答关键,注意通过反应的现象结合离子的性质进行推断,要排除实验操作的干扰.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
12.下列离子方程式正确的是( )
| A. | HCO3-水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| B. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2+2OH- | |
| C. | 氨水溶解氯化银固体:AgCl+2NH3•H2O═[Ag(NH3)2]++Cl-+2H2O | |
| D. | 将饱和FeCl3溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
9.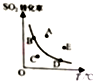 对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )
对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )
 对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )
对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )| A. | A点 | B. | B、D两点 | C. | C点 | D. | A、E两点 |
13. 英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )
英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )
 英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )
英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )| A. | 该材料完全由金属元素构成 | |
| B. | 该材料能捕集CO2,是因为该材料可以选择性吸收CO2 | |
| C. | 该材料捕集11.2LCO2后,增重22g | |
| D. | 可利用该材料将空气中的CO2,完全捕集,从而控制温室效应 |
10.下列关于同分异构体的说法中正确的是( )
| A. | 相对分子质量相同,结构不同的化合物互为同分异构体 | |
| B. | 同分异构体间的相互转化不存在能量的变化 | |
| C. | C4H10的一氯代物共2种结构 | |
| D. | 甲苯( )苯环上的氢原子被一个氯原子取代后的产物共有3种 )苯环上的氢原子被一个氯原子取代后的产物共有3种 |
11.利用如图装置收集下列各种气体并进行相应性质实验,你认为发生的现象和得出的结论合理的是( )
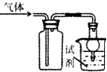

| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | X | 澄清石灰水 | 溶液变浑浊 | X一定是CO2 |
| B | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2具有酸性和漂白性 |
| C | NO2 | KI淀粉溶液 | 溶液变为蓝色 | NO2水溶液具有氧化性 |
| D | NH3 | 酚酞试液 | 溶液变为红色 | NH3属于碱 |
| A. | A | B. | B | C. | C | D. | D |
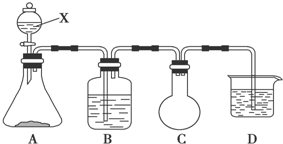
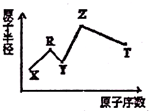 现有X、Y、Z、R、T五种短周期主族元素,R原子电子数是电子层数的3倍:Y与X能形成X2Y、X2Y2型共价化合物,Z与T形成的Z2T型离子化合物.五种元素的原子半径与原子序数的关系如图所示.回答下列问题:
现有X、Y、Z、R、T五种短周期主族元素,R原子电子数是电子层数的3倍:Y与X能形成X2Y、X2Y2型共价化合物,Z与T形成的Z2T型离子化合物.五种元素的原子半径与原子序数的关系如图所示.回答下列问题: .
.