题目内容
7.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | 常温下,c(H+)/c(OH-)=1010的溶液中:Na+、NH4+、ClO-、I- | |
| C. | 水电离出的c(H+)=10-12mol•L-1的溶液:K+、Na+、CO32-、Br- | |
| D. | 含有0.1mol•LHCO3-的溶液:Na+、Fe3+、NO3-、SCN- |
分析 A.使甲基橙变红色的溶液为酸性溶液,溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
B.常温下,c(H+)/c(OH-)=1010的溶液中存在大量氢离子,次氯酸根离子能够氧化碘离子,次氯酸根离子能够与氢离子结合生成次氯酸;
C.水电离出的c(H+)=10-12mol•L-1的溶液为酸性或碱性溶液,碳酸根离子能够与酸性溶液中的氢离子反应;
D.铁离子与硫氰根离子生成硫氰化铁,与碳酸氢根离子发生双水解反应.
解答 解:A.使甲基橙变红色的溶液中存在大量氢离子,Mg2+、K+、SO42-、NO3-之间不发生反应,且都不与氢离子反应,能够大量共存,故A正确;
B.常温下,c(H+)/c(OH-)=1010的溶液为酸性溶液,溶液中存在大量氢离子,ClO-、I-之间发生氧化还原反应,ClO-与氢离子反应生成次氯酸,在溶液中不能大量共存,故B错误;
C.水电离出的c(H+)=10-12mol•L-1的溶液中存在大量氢离子或氢氧根离子,CO32-与氢离子反应,在酸性溶液中不能大量共存,故C错误;
D.Fe3+、SCN-之间反应生成络合物硫氰化铁,之间发生双水解反应生成氢氧化铁沉淀和二氧化碳气体,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

| A. | 利用天然气做燃料可以有效地减少“温室效应”的气体产生 | |
| B. | 由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分 | |
| C. | 可以用浸泡过高锰酸钾溶液的硅土来吸收水果或花朵产生的乙烯,达到保鲜目的 | |
| D. | 福尔马林是甲醛的水溶液,具有杀菌防腐能力,但不能用福尔马林保鲜鱼肉等食品 |
| A. | 元素W、X的氯化物中,各原子均满足最外层8电子的稳定结构 | |
| B. | 元素X与W形成的原子数比为1:1的化合物有很多种,且都存在非极性键 | |
| C. | 非金属性:Z>X | |
| D. | 元素Z可与元素Y形成化合物Y2Z3,该化合物易水解 |
| A. | HCO3-水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| B. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2+2OH- | |
| C. | 氨水溶解氯化银固体:AgCl+2NH3•H2O═[Ag(NH3)2]++Cl-+2H2O | |
| D. | 将饱和FeCl3溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
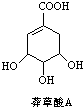 为原料的有机合成路线:
为原料的有机合成路线:
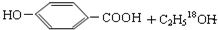 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$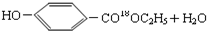 .
.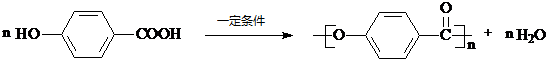 .
.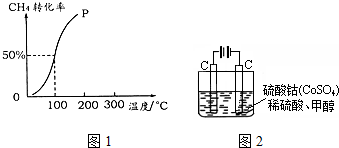
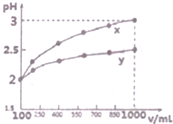 (1)现有浓度为0.1mol•-1的四种溶液①硫酸②醋酸③氢氧化钠④氯化铵.这四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①(填序号).
(1)现有浓度为0.1mol•-1的四种溶液①硫酸②醋酸③氢氧化钠④氯化铵.这四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①(填序号).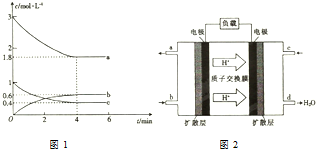 甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景,在催化剂作用下可用H2(g)+CO(g)$\stackrel{催化剂}{?}$CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图1所示.
甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景,在催化剂作用下可用H2(g)+CO(g)$\stackrel{催化剂}{?}$CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图1所示.