题目内容
11.下列变化中属于原电池反应的是( )| A. | 在空气中金属铝表面迅速氧化形成保护层 | |
| B. | 钢铁在潮湿的空气中生锈 | |
| C. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层 | |
| D. | 钢管被原油中的含硫化合物腐蚀 |
分析 属于原电池反应,说明符合原电池的构成条件,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,以此解答.
解答 解:A.金属铝是比较活泼的金属,在空气中放置的时候能与氧气反应,表面迅速被氧化形成致密的保护膜,与原电池无关,故A错误;
B.钢铁为合金,可形成原电池反应而被腐蚀,为电化学腐蚀,故B正确;
C.红热的铁丝和水直接反应生成黑色的四氧化三铁和氢气,不符合原电池构成条件,属于化学腐蚀,故C错误;
D.钢管被含硫化合物腐蚀为化学腐蚀,生成硫化物,因原油不导电,则没有形成原电池反应,故D错误.
故选B.
点评 本题考查了化学腐蚀和电化学腐蚀的判断,为高频考点,侧重于学生的分析能力的考查,根据原电池构成条件来分析解答即可,难度不大.

练习册系列答案
相关题目
1.如图是一些常见有机物的转化关系,关于反应①~⑫的说法不正确的是( )
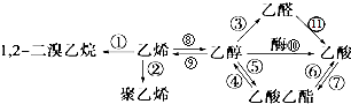

| A. | 有①②⑧三个反应均属于加成反应 | B. | 只有②发生的是加聚反应 | ||
| C. | 总共有4个反应是氧化反应 | D. | 反应④⑤⑥⑦是取代反应 |
2.短周期元素W、X、Y和Z的原子序数依次增大.元素W的一种核素不含中子,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
| A. | 元素W、X的氯化物中,各原子均满足最外层8电子的稳定结构 | |
| B. | 元素X与W形成的原子数比为1:1的化合物有很多种,且都存在非极性键 | |
| C. | 非金属性:Z>X | |
| D. | 元素Z可与元素Y形成化合物Y2Z3,该化合物易水解 |
20.下列球棍模型表示的是异丁烷的是( )
| A. | 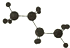 | B. |  | C. | 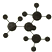 | D. | 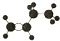 |
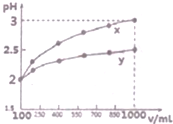 (1)现有浓度为0.1mol•-1的四种溶液①硫酸②醋酸③氢氧化钠④氯化铵.这四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①(填序号).
(1)现有浓度为0.1mol•-1的四种溶液①硫酸②醋酸③氢氧化钠④氯化铵.这四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①(填序号).
 如图是几种重要的有机物及部分转化关系,请回答下列问题:
如图是几种重要的有机物及部分转化关系,请回答下列问题: