题目内容
【题目】已知:25 ℃时某些弱酸的电离平衡常数如表。
CH3COOH | HClO | H2CO3 |
Ka=1.75×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
下面图像表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。
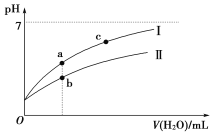
(1)相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是____________________。
(2)向NaClO溶液中通入少量二氧化碳的离子方程式为______________。
(3)图像中a、c两点处的溶液中![]() ________(HR代表CH3COOH或HClO,填“相等”或“不相等”)。
________(HR代表CH3COOH或HClO,填“相等”或“不相等”)。
(4)图像中a点酸的总浓度________(填“大于”“小于”或“等于”)b点酸的总浓度。
【答案】(1)c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+)(3分)
(2)ClO-+CO2+H2O===HClO+![]() (2分) (3)相等(2分) (4)小于(2分)
(2分) (3)相等(2分) (4)小于(2分)
【解析】根据表中电离平衡常数可知:酸性由强至弱的顺序为CH3COOH>H2CO3>HClO>![]() ,结合质子的能力由大到小的顺序为
,结合质子的能力由大到小的顺序为![]() >ClO->
>ClO->![]() >CH3COO-。
>CH3COO-。
(1)ClO-的水解程度大于CH3COO-的水解程度,同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系应是c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+)。
(2)由H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11,HClO的Ka=3.0×10-8,可知ClO-结合质子的能力大于HCO小于![]() ,离子方程式应为ClO-+CO2+H2O===HClO+
,离子方程式应为ClO-+CO2+H2O===HClO+![]() 。
。
(3)![]() 变形为
变形为![]() ,该式即为K电离/Kw,温度相同,则该式的值相等。
,该式即为K电离/Kw,温度相同,则该式的值相等。
(4)相同pH的CH3COOH和HClO,HClO的浓度大于CH3COOH的浓度,稀释到相同体积时,HClO(Ⅱ)浓度大于CH3COOH(Ⅰ)浓度。即a点酸(CH3COOH)的总浓度小于b点酸(HClO)的总浓度。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案