题目内容
【题目】下表所示是几种弱电解质的电离平衡常数和某难溶电解质的溶度积Ksp(25 ℃)。
电解质 | 平衡方程式 | 电离平衡常数 | Ksp |
CH3COOH | CH3COOH | 1.76×105 | |
H2CO3 | H2CO3 HC | Ka1=4.31×107 Ka2=5.61×1011 | |
C6H5OH | C6H5OH | 1.1×1010 | |
H3PO4 | H3PO4
| Ka1=7.52×103 Ka2=6.23×108 Ka3=2.20×1013 | |
NH3·H2O | NH3·H2O | 1.76×105 | |
BaSO4 | BaSO4(s) | 1.07×1010 |
回答下列问题:
(1)由上表分析,若①CH3COOH,②![]() ,③C6H5OH,④
,③C6H5OH,④![]() 均可看成酸,则它们的酸性由强到弱的顺序为 (填编号)。
均可看成酸,则它们的酸性由强到弱的顺序为 (填编号)。
(2)25 ℃时,将等体积、等浓度的CH3COOH溶液和氨水混合,混合液中:c(CH3COO) (填“>”“=”或“<”)c(![]() )。
)。
(3)25 ℃时,向10 mL 0.01 mol·L1苯酚溶液中滴加V mL 0.01 mol·L1氨水,下列说法正确的是 (填序号)。
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(![]() )>c(C6H5O)>c(H+)>c(OH)
)>c(C6H5O)>c(H+)>c(OH)
C.V=10时,混合液中水的电离程度小于10 mL 0.01 mol·L1苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+2c(![]() )=c(C6H5O)+c(C6H5OH)
)=c(C6H5O)+c(C6H5OH)
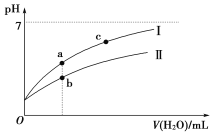
(4)如图所示为某温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是 (填序号)。
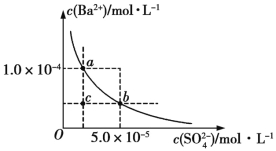
A.加入Na2SO4可使溶液由a点变为b点
B.在曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由c点变为曲线上a、b之间的某一点(不含a、b)
D.升高温度,可使溶液由b点变为c点
【答案】(1)①④③② (2)= (3)D (4)D
【解析】解答本题的关键是理清电离平衡常数、溶度积的含义及影响因素。(1)根据电离平衡常数的大小可判断酸的相对强弱,平衡常数越小,酸性越弱。(2)将等体积、等浓度的CH3COOH溶液和氨水混合,恰好生成CH3COONH4,由于CH3COOH和NH3·H2O的电离平衡常数相等,所以![]() 和CH3COO的水解程度相同,故混合液中c(CH3COO)=c(
和CH3COO的水解程度相同,故混合液中c(CH3COO)=c(![]() )。(3)A项错误,
)。(3)A项错误,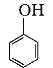 +NH3·H2O
+NH3·H2O![]()
![]() +H2O,
+H2O,![]() 的水解程度远远大于
的水解程度远远大于![]() 的水解程度,V略小于10时,pH也可能大于7;B项错误,该式不符合电荷守恒;C项错误,
的水解程度,V略小于10时,pH也可能大于7;B项错误,该式不符合电荷守恒;C项错误,![]() 促进水的电离,而
促进水的电离,而![]() 抑制水的电离;D项正确,当V=5时,是
抑制水的电离;D项正确,当V=5时,是![]() 和
和![]() 的混合溶液,且二者的物质的量相等,根据物料守恒可判断该式正确。(4)A项正确,温度不变,Ksp不变,c(
的混合溶液,且二者的物质的量相等,根据物料守恒可判断该式正确。(4)A项正确,温度不变,Ksp不变,c(![]() )增大,c(Ba2+)减小;B项正确,曲线上方区域(不含曲线)的任意一点均为过饱和溶液,均有BaSO4沉淀生成;C项正确,蒸发溶剂,c(
)增大,c(Ba2+)减小;B项正确,曲线上方区域(不含曲线)的任意一点均为过饱和溶液,均有BaSO4沉淀生成;C项正确,蒸发溶剂,c(![]() )和c(Ba2+)均增大,而由c点到a点c(
)和c(Ba2+)均增大,而由c点到a点c(![]() )保持不变,由c点到b点c(Ba2+)保持不变,故溶液可能由c点变为曲线上a、b之间的某一点(不含a、b);D项错误,升高温度,Ksp增大,c(Ba2+)和c(
)保持不变,由c点到b点c(Ba2+)保持不变,故溶液可能由c点变为曲线上a、b之间的某一点(不含a、b);D项错误,升高温度,Ksp增大,c(Ba2+)和c(![]() )均应增大。
)均应增大。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案