题目内容
【题目】氮的氧化物和硫的氧化物是导致酸雨的物质。
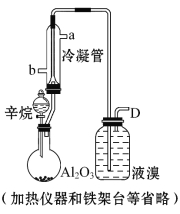
(1)形成酸雨的原理之一可简单表示如下:
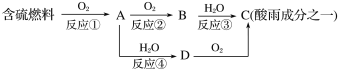
回答下列问题:
①酸雨的pH________(填“>”、“<”或“=”)5.6。
②D物质的化学式为____________。
③反应②的化学方程式为_________________________________________。
(2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:__________________,反应中氧化剂是____________,还原剂是_______________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O,2NO2+2NaOH===NaNO2+NaNO3+H2O
现有V L某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为________ mol·L1。
②若所得溶液中c(![]() )∶c(
)∶c(![]() )=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=______。
)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=______。
③用含n和m的代数式表示所得溶液中![]() 和
和![]() 浓度的比值c(
浓度的比值c(![]() )∶c(
)∶c(![]() )=________。
)=________。
【答案】(1)①< ②H2SO3 ③2SO2+O2![]() 2SO3
2SO3
(2)6NO2+8NH3![]() 7N2+12H2O NO2 NH3
7N2+12H2O NO2 NH3
(3)①![]() ②3∶2 ③
②3∶2 ③![]()
【解析】(1)酸雨的pH<5.6,正常雨水的pH=5.6。由图示转化可知:A为SO2,B为SO3,D为H2SO3。
(2)NH3 和NO2反应生成的无污染物质是N2和H2O。
(3)①因产物NaNO3、NaNO2中n(Na+)=n(N),故n(NaOH)=n(NO)+n(NO2)=(m+n) mol,c(NaOH)=![]() mol·L1。②NO2与NO混合气体与NaOH溶液反应可以认为先后发生如下反应:
mol·L1。②NO2与NO混合气体与NaOH溶液反应可以认为先后发生如下反应:
NO2+NO+2NaOH===2NaNO2+H2O
m m 2m 2m
2NO2+2NaOH===NaNO2 + NaNO3 + H2O
nm ![]() (nm)
(nm) ![]() (nm)
(nm)
当V(NO)2≥V(NO)时能吸收完全,所以c(![]() )∶c(
)∶c(![]() )=
)= =
=![]() ,得n∶m=3∶2。
,得n∶m=3∶2。
③c(![]() )∶c(
)∶c(![]() )=
)=![]() (nm)∶[2m+
(nm)∶[2m+![]() (nm)]=
(nm)]=![]() 。
。