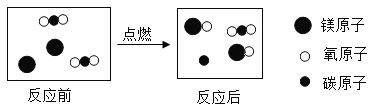
题目内容
【题目】认识物质及其变化,对于了解自然现象和规律至关重要。
(1)下列是初中化学常见的实验或操作,回答下列问题:
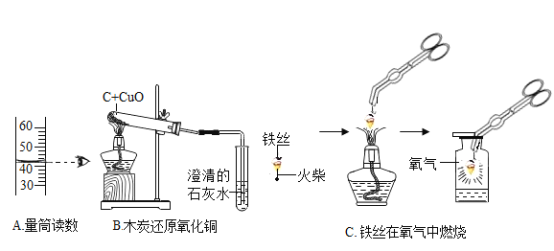
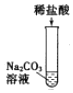
①A实验中读出液体的体积为_____mL。
②B实验中观察到的实验现象是_____。
③C实验集气瓶内预先装入少量的水的目的是_____,铁丝燃烧的化学方程式为_____。
(2)在烧杯中加入5.74g久置于空气中的铝箔,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如图所示。请回答下列问题:
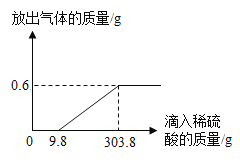
①产生氢气(H2)的总质量为_____;
②刚滴加稀硫酸时无氢气放出,是因为稀硫酸与铝箔表面的物质_____(填化学式)反应,该物质与稀硫酸反应的化学方程式为_____。
③请计算铝箔中含有金属铝的质量_____。
【答案】46 左边试管中黑色固体变红色,右边试管中溶液变浑浊 防止铁燃烧形成的高温熔融物溅落时炸裂集气瓶 3Fe+2O2![]() Fe3O4 0.6g Al2O3 Al2O3+3H2SO4═Al2(SO4)3+3H2O 5.4g
Fe3O4 0.6g Al2O3 Al2O3+3H2SO4═Al2(SO4)3+3H2O 5.4g
【解析】
(1)①A实验中读出液体的体积为46mL;
②B实验中氧化铜和碳反应生成铜和二氧化碳,二氧化碳能使澄清石灰水变浑浊,观察到的实验现象是左边试管中黑色固体变红色,右边试管中溶液变浑浊;
③C实验集气瓶内预先装入少量的水的目的是 防止铁燃烧形成的高温熔融物溅落时炸裂集气瓶,铁丝燃烧的化学方程式为:3Fe+2O2![]() Fe3O4;
Fe3O4;
(2)①产生氢气(H2)的总质量为0.6g;
②刚滴加稀硫酸时无氢气放出,是因为稀硫酸与铝箔表面的物质Al2O3反应,该物质与稀硫酸反应生成硫酸铝和水,反应的化学方程式为:Al2O3+3H2SO4═Al2(SO4)3+3H2O;
③设铝箔中含有金属铝的质量为x,
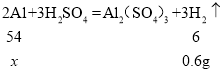
![]()
x=5.4g,
答:铝箔中含有金属铝的质量为5.4g。

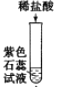
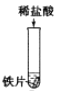
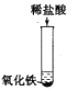
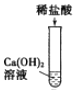
【题目】为探究酸的化学性质,某化学小组利用盐酸进行了如下实验操作:
实验 | A | B | C | D | E |
请回答:
(1)写出E中反应的化学方程式______。
(2)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行如下探究:
(提出问题)滤液中溶质的成分是什么?
(作出猜想)
猜想一:NaCl
猜想二:NaCl和CaCl2
猜想三:NaCl、CaCl2和Na2CO3
猜想四:______。
(进行讨论)经过讨论,同学们一致认为猜想______是错误的。
(设计实验)请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量的碳酸钠溶液 | 无明显现象 | 猜想二不成立 |
取少量滤液于试管中,滴加氯化钡溶液 | ______ | 猜想四成立 |
(反思拓展)在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑____。
【题目】Fenton法常用于处理含难降解有机物的工业废水。其原理是利用Fe2+和H2O2的反应产生能降解污染物的活性成分。现运用该方法降解有机污染物p-CP,探究有关因素对降解反应速率的影响。
实验探究:控制p-CP的初始浓度相同,实验温度恒定在25℃或40℃(其余实验条件见下表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
实验编号 | 实验目的 | 温度/℃ | pH | 浓度/(mg·L-1) | |
H2O2 | Fe2+ | ||||
① | 为②③提供参照 | 25 | 3 | 204 | 16.8 |
② | 探究温度对降解反应速率的影响 | ________ | ________ | 204 | 16.8 |
③ | ________ | 25 | 10 | 204 | 16.8 |
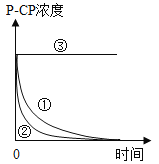
实验测得p-CP的浓度随时间变化的关系如图。
(2)实验发现,温度过高时,降解反应较难发生。请从Fenton法所用试剂的角度分析原因:__________。
(3)为测定不同时间内有机物降解的浓度,需在不同时间从反应器中取样,并使所取样品中的降解反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:____________________。