题目内容
【题目】实验小组用传感器探究稀NaOH 溶液与稀盐酸反应过程中温度和 pH 的变化,测定结果如(如下图所示)。下列说法错误的是( )
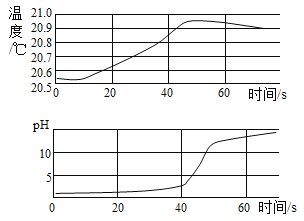
A.反应过程中有热量放出
B.该实验是将稀NaOH 溶液滴入稀盐酸
C.30s 时,溶液中溶质为HCl 和NaCl
D.40s 时,氢氧化钠与盐酸恰好完全反应
【答案】D
【解析】
A、反应过程中,温度升高说明有热量放出,选项正确,不符合题意。
B、溶液刚开始pH小于7显酸性,反应后pH大于7显碱性,故是将稀NaOH 溶液滴入稀盐酸,选项正确,不符合题意。
C、盐酸和氢氧化钠反应生成氯化钠,30s 时,pH小于7说明氢氧化钠不足,盐酸有剩余,溶液中溶质为HCl 和NaCl,选项正确,不符合题意。
D、40s 时,溶液pH小于7,氢氧化钠不足,酸过量,没有恰好完全反应,选项错误,符合题意。
故选:D。

【题目】化学实验室里,同学们准备研究氢氧化钠能与二氧化碳反应的化学性质。
①在配制NaOH溶液时,看到盛有NaOH固体的试剂瓶上标注着“NaOH含量不少于96.0%”,便对该瓶试剂成分产生了质疑:
[提出问题]氢氧化钠中含有什么杂质?
[查阅资料]工业上制取NaOH的反应原理: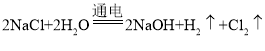 然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
[提出猜想]
甲同学认为杂质只有氯化钠;
乙同学认为杂质还可能含有碳酸钠,原因为_______ (用化学方程式表示)。
[设计实验]取样溶于水,并分成两份。
步骤1:向一份溶液中滴加酚酞试液,溶液变_________色。
步骤2:向另一份溶液中滴加过量稀硝酸,有气泡产生。
步骤3:向步骤 2所得溶液中继续滴加_________溶液,发现有白色沉淀产生。
[实验结论]乙同学的猜想正确。
请
Ⅰ.上述实验中步骤_____(填序号)是没有必要进行的。
II.步骤2所得溶液中的溶质有________。
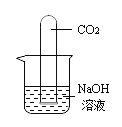
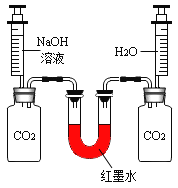
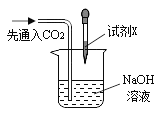
②同学们在配制好的氢氧化钠溶液中通入CO2气体,没有明显现象,于是设计了如下实验证明反应的发生:(不考虑氢氧化钠中的极少量杂质)
实验1 | 实验2 | 实验3 |
现象:烧杯中溶液几乎充满整个试管。 |
现象: 充分反应后,红墨水最终呈现左高右低现象。 |
现象: 滴加试剂X后,溶液中出现大量白色沉淀。 |
I .实验3中加入的试剂X是_______ (任写一种符合要求的试剂)。
II.实验1、2在设计思想上是一致的,都是通过验证反应物的消耗才能观察到明显现象,但有同学对实验1提出了质疑,他认为这个实验不足以证明CO2与NaOH发生了化学反应,其理由是_______。
Ⅲ.查阅资料:室温下,氢氧化钠易溶于酒精,而碳酸钠难溶于酒精。据此,同学们设计了实验4,请你补充完整。
实验4步骤 | 实验现象 | 实验结论 | 实验分析 |
将CO2气体不断地通入氢氧化钠酒精溶液中,观察现象。 | _______ | 氢氧化钠与二氧化碳确实发生了化学反应。 | 实验4与实验____(填实验序号)的设计思想是一致的,都是根据生成物的性质才能观察到明显现象。 |
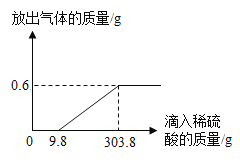
【题目】为测定某样品中锌的质量分数,取10g此样品,分五次向其中加入稀硫酸使之充分反应(假设锌的样品中杂质不与稀硫酸反应,且不溶于水),每次加入的稀硫酸质量及测定剩余固体的质量,记录数据如下表:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入稀硫酸的质量/g | 10 | 10 | 10 | 10 | 10 |
剩余固体质量/g | 8.4 | 6.8 | 5.2 | 3.6 | 3.6 |
请认真分析表中的数据,回答下列问题:
(1)表示样品与稀硫酸恰好完全反应的是上表中第________次操作;
(2)计算样品中锌的质量分数; ____
(3)计算实验中所用稀硫酸的溶质质量分数。 ______