题目内容
【题目】化学与人类生活、生产活动息息相关。根据所学化学知识回答下列问题:
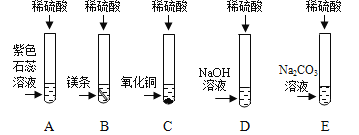
①自来水厂净水过程中除去色素和异味用到_____,其作用是吸附作用:
②家用天然气的主要成分是甲烷,写出甲烷燃烧的化学方程式_____;
③炒菜时,不小心将食盐洒落在火焰上,会发出_____颜色。
④复课后,学校每天会在教室喷撒二氧化氯(ClO2)溶液等消毒液,喷洒后,室内充满消毒液气味,这说明_____(从微观角度分析),ClO2由_____种元素组成,其中Cl元素的化合价为_____,1molClO2中约含_____个Cl原子。
【答案】活性炭 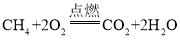 黄 分子不断运动 2 +4 6.02×1023
黄 分子不断运动 2 +4 6.02×1023
【解析】
①活性炭具有吸附性,可以吸附水中的色素和异味,故填:活性炭;
②甲烷燃烧生成二氧化碳和水,该反应的化学方程式为: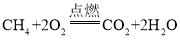 ;
;
③ 氯化钠中含钠离子,钠离子燃烧发出黄色火焰,故填:黄;
④分子是不断运动的,二氧化氯分子四处扩散,因此教室里充满消毒液气味,故填:分子不断运动;
ClO2由Cl、O两种元素组成,故填:2;
氧元素通常为-2价,设ClO2中氯元素的化合价为x,根据化合物中,正、负化合价的代数和为零,可得:x+(-2)×2=0,x=+4;
1molClO2中约含:1mol×6.02×1023=6.02×1023个氯原子,故填:6.02×1023。

 智能训练练测考系列答案
智能训练练测考系列答案【题目】化学实验室里,同学们准备研究氢氧化钠能与二氧化碳反应的化学性质。
①在配制NaOH溶液时,看到盛有NaOH固体的试剂瓶上标注着“NaOH含量不少于96.0%”,便对该瓶试剂成分产生了质疑:
[提出问题]氢氧化钠中含有什么杂质?
[查阅资料]工业上制取NaOH的反应原理: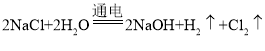 然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
[提出猜想]
甲同学认为杂质只有氯化钠;
乙同学认为杂质还可能含有碳酸钠,原因为_______ (用化学方程式表示)。
[设计实验]取样溶于水,并分成两份。
步骤1:向一份溶液中滴加酚酞试液,溶液变_________色。
步骤2:向另一份溶液中滴加过量稀硝酸,有气泡产生。
步骤3:向步骤 2所得溶液中继续滴加_________溶液,发现有白色沉淀产生。
[实验结论]乙同学的猜想正确。
请
Ⅰ.上述实验中步骤_____(填序号)是没有必要进行的。
II.步骤2所得溶液中的溶质有________。
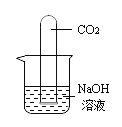
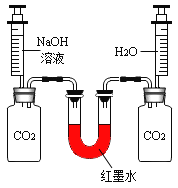
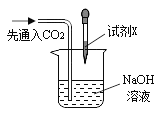
②同学们在配制好的氢氧化钠溶液中通入CO2气体,没有明显现象,于是设计了如下实验证明反应的发生:(不考虑氢氧化钠中的极少量杂质)
实验1 | 实验2 | 实验3 |
现象:烧杯中溶液几乎充满整个试管。 |
现象: 充分反应后,红墨水最终呈现左高右低现象。 |
现象: 滴加试剂X后,溶液中出现大量白色沉淀。 |
I .实验3中加入的试剂X是_______ (任写一种符合要求的试剂)。
II.实验1、2在设计思想上是一致的,都是通过验证反应物的消耗才能观察到明显现象,但有同学对实验1提出了质疑,他认为这个实验不足以证明CO2与NaOH发生了化学反应,其理由是_______。
Ⅲ.查阅资料:室温下,氢氧化钠易溶于酒精,而碳酸钠难溶于酒精。据此,同学们设计了实验4,请你补充完整。
实验4步骤 | 实验现象 | 实验结论 | 实验分析 |
将CO2气体不断地通入氢氧化钠酒精溶液中,观察现象。 | _______ | 氢氧化钠与二氧化碳确实发生了化学反应。 | 实验4与实验____(填实验序号)的设计思想是一致的,都是根据生成物的性质才能观察到明显现象。 |